6.4 Induktívny a deduktívny spôsob zavádzania fyzikálnych pojmov
Vedecké spôsobilosti, či inak spôsobilosti pre vedeckú prácu, z ktorých sa odvodzujú ciele vzdelávania v prírodovedných predmetoch, sa často dávajú do kontextu s induktívnym prístupom zavádzania pojmov vo vyučovaní. Termíny induktívny a deduktívny prístup sa dostali do školsko-politického prostredia v spojitosti so správou Science education Now: A Renewed Pedagogy for the Future of Europa (2007). V správe skupina významných vedcov z oblasti prírodovedného vzdelávania a popularizácie vedy konštatuje, že v školskej praxi prevažuje deduktívny prístup, čo je príčinou úpadku prírodovedného vzdelania. Na druhej strane induktívny prístup dáva priestor na vlastné skúmanie a tvorbu pojmov.
6.4.1 Induktívny spôsob na príklade zavedenia pojmu teplo
Induktívny postup v spojitosti s primeraným obsahom a premyslenými učebnými aktivitami dáva priestor rozvíjať u žiakov didakticky adaptované spôsobilosti vedeckej práce, ktoré sú dnes súčasťou obsahu vyučovania fyziky. Induktívny spôsob predstavíme na príklade zavedenia pojmu teplo podľa článku od Lapitkovej (2015, s. 32-37). Spôsobilosti prevzaté z vedeckej práce tvoria súčasť prírodovednej gramotnosti, ktorá sa skladá z dokonalého osvojenia základných poznatkov a z osvojenia spôsobilostí vedeckej práce, pod čím rozumieme – cieľavedomé pozorovanie, klasifikáciu objektov, vytváranie hypotéz, kladenie otázok, zbieranie dát a následné testovanie hypotéz, zodpovedanie otázok, interpretovanie výsledkov meraní. Jednotlivé aspekty spôsobilostí k vedeckej práci sa teraz vzťahujú na žiaka. Predtým sa v didaktike fyziky tento problém riešil pod názvom empirický model poznávania a išlo skôr o usporiadanie, modelovanie obsahu vyučovania z hľadiska učiteľa.
Induktívny prístup sa spája s indukciou ako myšlienkovou operáciou, čo znamená, že z konkrétnych, jedinečných tvrdení sa vyvodzujú všeobecné súdy. Využitie induktívneho postupu ukážeme na konkrétnom zavedení pojmu teplo na základnej škole, pričom chceme zdôrazniť využitie historických prvkov v tomto postupe.
Priestor na identifikovanie skúseností žiaka s odovzdávaním tepla dáva pokus, ktorý modeluje Galileiho termoskop – predchodca teplomera (obrázok 6.4).
 Prvou úlohou žiaka je zohrievať banku rukami a pozorovať pohyb, klesanie kvapalinového stĺpca, ktorý bol vytvorený následkom podtlaku v banke a v rúrke. Podtlak sme dosiahli miernym vytiahnutím piesta v striekačke. Následným ochladením banky studenou vodou sa kvapalinový stĺpec začne pohybovať smerom hore.
Úlohou žiakov je opísať pozorovanie a vysvetliť priebeh pokusu. Najčastejšie sa vo vysvetleniach žiakov objavuje rozťažnosť plynu, zväčšenie jeho objemu ako dôsledok odovzdávania tepla, a pri ochladzovaním nádoby zmenšenie objemu plynu.
Na konci tejto témy však prejdeme k hlbšiemu vysvetleniu, smerujeme k príčine zmeny objemu vzduchu v banke, a to k zmene pohybovej energie častíc plynu ako dôsledku odovzdaného tepla.
V druhom kroku by sa mali žiaci oboznámiť s chápaním tepla v minulosti – s teóriou kalorika a pokusmi Rumforda a Davyho. Z hľadiska ďalšieho poznávania je dôležité zdôraznenie výroku oboch bádateľov – teplo je druh pohybu. Práve téma teplo dáva vo vyučovaní priestor na zohľadnenie vývoja vedeckého poznania, zmien vo vysvetľovaní javov, a tým aj celých teórií.
V ďalšom, treťom kroku, je dôležité uvažovať so žiakmi o ich skúsenosti – aké zmeny môže vyvolať zohrievanie či ochladzovanie plynných, kvapalných a tuhých telies. Tento krok pomáha prepojiť praktickú skúsenosť žiaka s odbornými pomenovaniami a vysvetleniami.
O tom, že sa teplo môže šíriť vedením, prúdením a žiarením, by sa žiaci mali presvedčiť jednoduchými experimentmi, ktorých súčasťou je aj zostrojenie kalorimetra z jednoduchých pomôcok (obrázok 6.5). Zostrojenie kalorimetra je veľmi dôležitý krok pri ďalšom experimentovaní. Vďaka jeho izolačným vlastnostiam prebieha v ňom výmena bez väčších strát.
Prvou úlohou žiaka je zohrievať banku rukami a pozorovať pohyb, klesanie kvapalinového stĺpca, ktorý bol vytvorený následkom podtlaku v banke a v rúrke. Podtlak sme dosiahli miernym vytiahnutím piesta v striekačke. Následným ochladením banky studenou vodou sa kvapalinový stĺpec začne pohybovať smerom hore.
Úlohou žiakov je opísať pozorovanie a vysvetliť priebeh pokusu. Najčastejšie sa vo vysvetleniach žiakov objavuje rozťažnosť plynu, zväčšenie jeho objemu ako dôsledok odovzdávania tepla, a pri ochladzovaním nádoby zmenšenie objemu plynu.
Na konci tejto témy však prejdeme k hlbšiemu vysvetleniu, smerujeme k príčine zmeny objemu vzduchu v banke, a to k zmene pohybovej energie častíc plynu ako dôsledku odovzdaného tepla.
V druhom kroku by sa mali žiaci oboznámiť s chápaním tepla v minulosti – s teóriou kalorika a pokusmi Rumforda a Davyho. Z hľadiska ďalšieho poznávania je dôležité zdôraznenie výroku oboch bádateľov – teplo je druh pohybu. Práve téma teplo dáva vo vyučovaní priestor na zohľadnenie vývoja vedeckého poznania, zmien vo vysvetľovaní javov, a tým aj celých teórií.
V ďalšom, treťom kroku, je dôležité uvažovať so žiakmi o ich skúsenosti – aké zmeny môže vyvolať zohrievanie či ochladzovanie plynných, kvapalných a tuhých telies. Tento krok pomáha prepojiť praktickú skúsenosť žiaka s odbornými pomenovaniami a vysvetleniami.
O tom, že sa teplo môže šíriť vedením, prúdením a žiarením, by sa žiaci mali presvedčiť jednoduchými experimentmi, ktorých súčasťou je aj zostrojenie kalorimetra z jednoduchých pomôcok (obrázok 6.5). Zostrojenie kalorimetra je veľmi dôležitý krok pri ďalšom experimentovaní. Vďaka jeho izolačným vlastnostiam prebieha v ňom výmena bez väčších strát.
 Aby sme žiaka postupne pripravovali na vzťah pre výpočet tepla, mal by mať skúsenosť s výmenou tepla medzi horúcou a studenou vodou, s pokusom, ktorý robil aj Fahrenheit. Keď zlievame rovnaké objemy horúcej a studenej vody, zjednodušíme kalorimetrickú rovnicu o hmotnosti telies a hmotnostné tepelné kapacity látok. Pri použití kalorimetra zhotoveného z jednoduchých pomôcok neberieme do úvahy teplo odovzdané kalorimetru. Pokusom sústredíme pozornosť žiaka na počiatočné teploty zlievaných objemov vody a na výslednú teplotu.
Žiaci niekoľkokrát opakujú pokus a predpovedajú hodnoty výslednej teploty, potom merajú výslednú teplotu a hodnoty zapisujú do tabuľky (Lapitková, 2010b, s. 71). Ich predpovede sú pri opakovaných meraniach obyčajne presnejšie, bližšie k reálnym hodnotám, až kým prídu na to, že výsledná teplota sa dá vypočítať tak, že sa sčítajú počiatočné teploty a vydelia dvoma. Následne môžu žiaci meniť aj objemy kvapalín a skúmať túto zmenu vo vzťahu k výslednej teplote.
Zavedeniu vzťahu pre výpočet tepla predchádza skúsenosť s výmenou tepla medzi kovmi a vodou. Žiaci merajú hmotnosti kovov a vody, pre zjednodušenie mala by výmena tepla prebehnúť medzi vodou s rovnakou hmotnosťou ako má kov. Zohrievame kov (v horúcej vode), ktorý po vložení do kalorimetra s vodou izbovej teploty, odovzdáva teplo. Dôležité v tomto postupe je zaviesť pre rozdiel teplôt znak Δt.
V triede sa predpokladá skupinová práca žiakov, pretože hodnoty namerané v každej skupine sa v závere merania zozbierajú a vytvoria podklad pre zostrojenie grafov (obr. 6.6).
Aby sme žiaka postupne pripravovali na vzťah pre výpočet tepla, mal by mať skúsenosť s výmenou tepla medzi horúcou a studenou vodou, s pokusom, ktorý robil aj Fahrenheit. Keď zlievame rovnaké objemy horúcej a studenej vody, zjednodušíme kalorimetrickú rovnicu o hmotnosti telies a hmotnostné tepelné kapacity látok. Pri použití kalorimetra zhotoveného z jednoduchých pomôcok neberieme do úvahy teplo odovzdané kalorimetru. Pokusom sústredíme pozornosť žiaka na počiatočné teploty zlievaných objemov vody a na výslednú teplotu.
Žiaci niekoľkokrát opakujú pokus a predpovedajú hodnoty výslednej teploty, potom merajú výslednú teplotu a hodnoty zapisujú do tabuľky (Lapitková, 2010b, s. 71). Ich predpovede sú pri opakovaných meraniach obyčajne presnejšie, bližšie k reálnym hodnotám, až kým prídu na to, že výsledná teplota sa dá vypočítať tak, že sa sčítajú počiatočné teploty a vydelia dvoma. Následne môžu žiaci meniť aj objemy kvapalín a skúmať túto zmenu vo vzťahu k výslednej teplote.
Zavedeniu vzťahu pre výpočet tepla predchádza skúsenosť s výmenou tepla medzi kovmi a vodou. Žiaci merajú hmotnosti kovov a vody, pre zjednodušenie mala by výmena tepla prebehnúť medzi vodou s rovnakou hmotnosťou ako má kov. Zohrievame kov (v horúcej vode), ktorý po vložení do kalorimetra s vodou izbovej teploty, odovzdáva teplo. Dôležité v tomto postupe je zaviesť pre rozdiel teplôt znak Δt.
V triede sa predpokladá skupinová práca žiakov, pretože hodnoty namerané v každej skupine sa v závere merania zozbierajú a vytvoria podklad pre zostrojenie grafov (obr. 6.6).
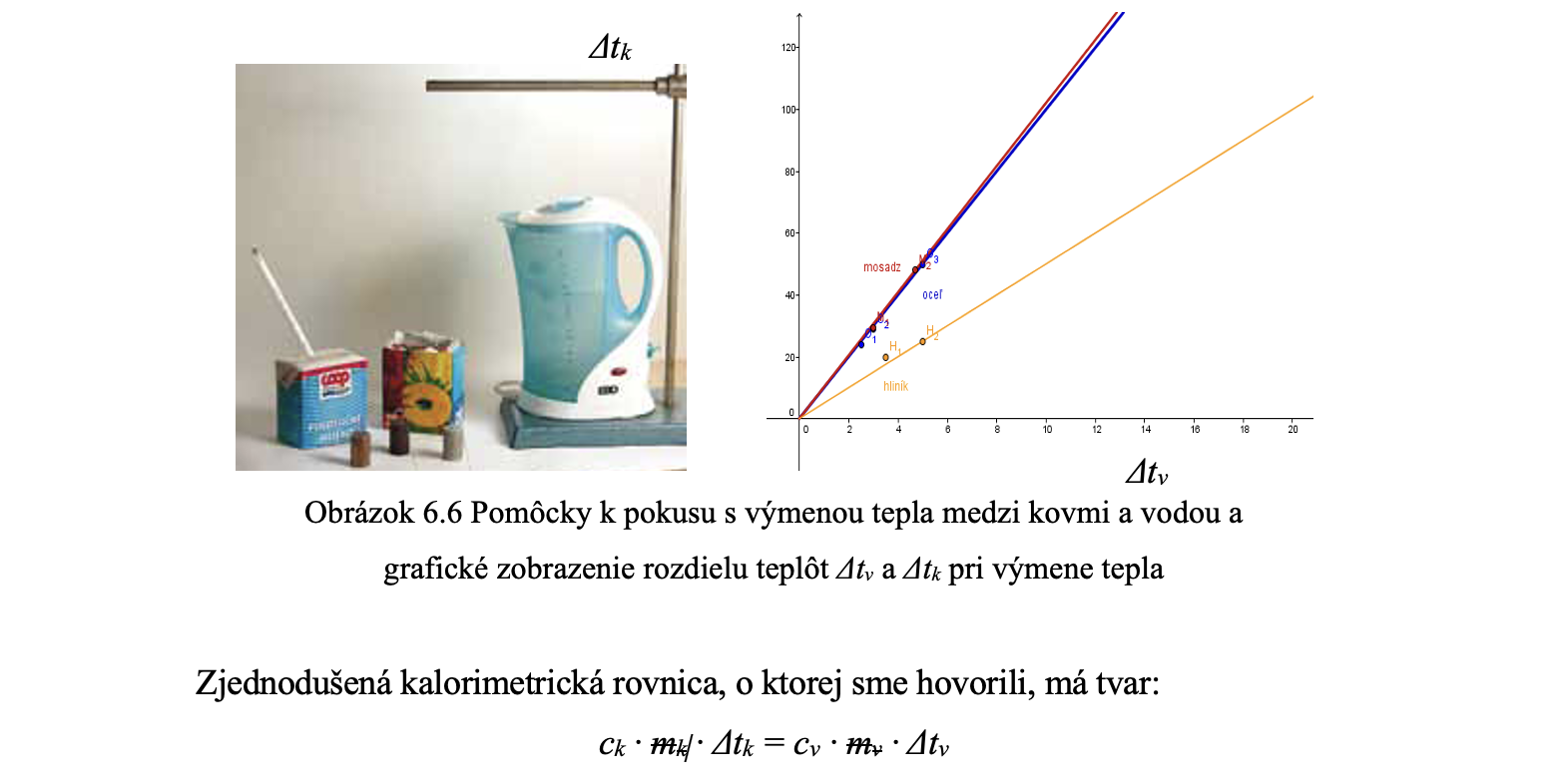 Pokiaľ by sme postupovali historickou cestou a do zavedenia mechanického ekvivalentu tepla ponechali ako jednotku tepla kalóriu, c vody bude mať hodnotu 1 cal/g·°C, môžeme hmotnostnú tepelnú kapacitu skúmaných kovov vypočítať ako podiel Δtv/Δtk .
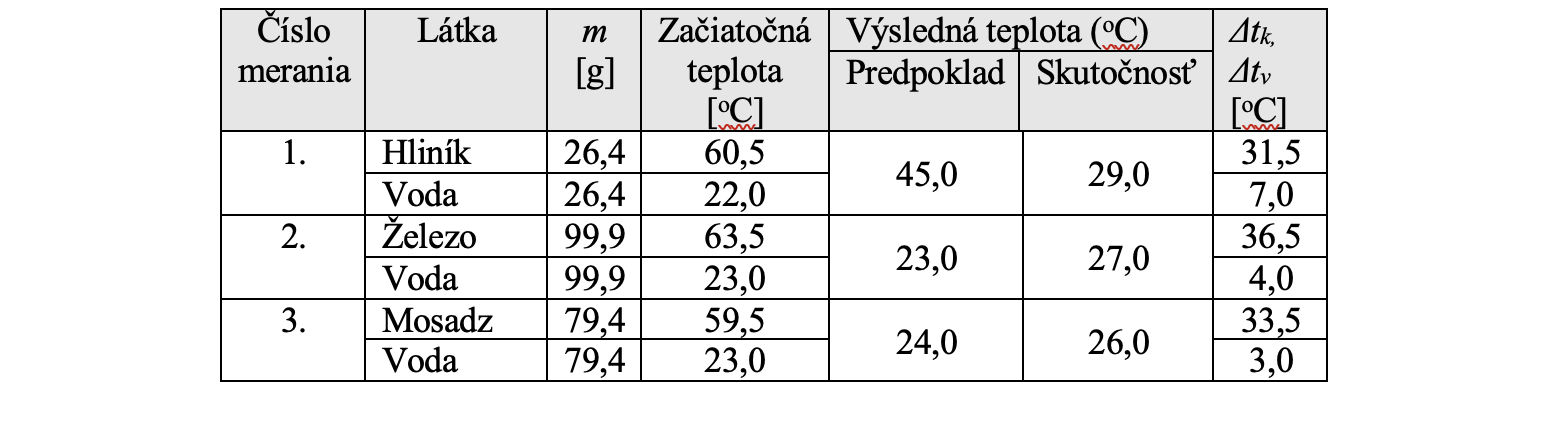
Z hodnôt Δtv, Δtk vieme vyčítať, že kým pri výmene tepla kovy dosiahli rozdiel teplôt o desiatky stupňov Celzia, zatiaľ voda zmenila svoju teplotu len o niekoľko stupňov (viď. Tabuľku 6.1).
Tabuľka 6.1 Výmena tepla medzi kovmi a vodou
Pokiaľ by sme postupovali historickou cestou a do zavedenia mechanického ekvivalentu tepla ponechali ako jednotku tepla kalóriu, c vody bude mať hodnotu 1 cal/g·°C, môžeme hmotnostnú tepelnú kapacitu skúmaných kovov vypočítať ako podiel Δtv/Δtk .
Z hodnôt Δtv, Δtk vieme vyčítať, že kým pri výmene tepla kovy dosiahli rozdiel teplôt o desiatky stupňov Celzia, zatiaľ voda zmenila svoju teplotu len o niekoľko stupňov (viď. Tabuľku 6.1).
Tabuľka 6.1 Výmena tepla medzi kovmi a vodou
 Po uvedených skúsenostiach žiakov s pozorovaním, meraním, experimentovaním a predpovedaním výsledných teplôt sa zavedie vzťah pre výpočet tepla.
V ďalšom kroku sa žiaci opäť vrátia k hodnotám nameraným pri odovzdávaní tepla medzi kovmi a vodou a počítajú teplo odovzdané kovom a teplo prijaté vodou. Graf zostrojený z vypočítaných hodnôt odovzdaného tepla kovom a tepla prijatého vodou vykazuje lineárnu závislosť.
Prechod jednotky tepla z kalórie na joule opäť prebieha cez meranie. Modelom Joulovho pokusu je zariadenie pozostávajúce z plastovej trubice s dĺžkou 1 m (obrázok 6.7), v ktorej sa presýpajú oceľové broky (napr. 300 g).
Po uvedených skúsenostiach žiakov s pozorovaním, meraním, experimentovaním a predpovedaním výsledných teplôt sa zavedie vzťah pre výpočet tepla.
V ďalšom kroku sa žiaci opäť vrátia k hodnotám nameraným pri odovzdávaní tepla medzi kovmi a vodou a počítajú teplo odovzdané kovom a teplo prijaté vodou. Graf zostrojený z vypočítaných hodnôt odovzdaného tepla kovom a tepla prijatého vodou vykazuje lineárnu závislosť.
Prechod jednotky tepla z kalórie na joule opäť prebieha cez meranie. Modelom Joulovho pokusu je zariadenie pozostávajúce z plastovej trubice s dĺžkou 1 m (obrázok 6.7), v ktorej sa presýpajú oceľové broky (napr. 300 g).
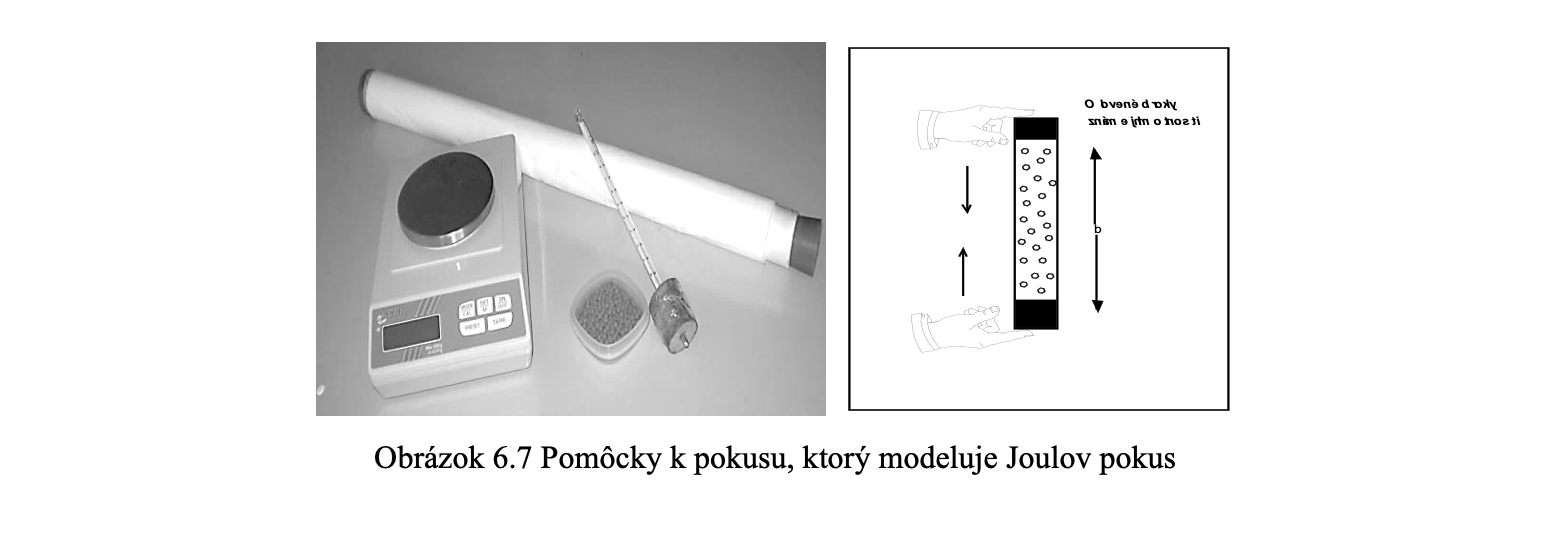 Práca sa koná v gravitačnom poli Zeme, broky padajú kolmo k zemi. Potrebujeme zmerať počiatočnú teplotu brokov, dĺžku trubice a po niekoľkonásobnom počte otočení trubice (30, 60, 90) aj výslednú teplotu brokov. Vypočíta sa vykonaná práca (J) a vyprodukované teplo (cal). Výpočtom alebo pomocou grafu, možno zistiť prácu potrebnú na vyprodukovanie tepla 1 cal. S veľkou pravdepodobnosťou sa nepodarí v školských podmienkach určiť presne vzťah 1 cal = 4,18 J, podarí sa však ukázať cestu, ako sa k hodnote 4,18 dospelo.
Dôležité je žiakom ukázať aj praktickú využiteľnosť určenia hodnoty prijatého či odovzdaného tepla, a to na príklade zisťovania energie potravín, čo možno pokusne ukázať v pokuse so spaľovaním orieška, ktorý odovzdáva teplo vode.
Na záver by sa mali žiaci opäť vrátiť k modelu Galileovho termoskopu. Očakávame, že ich vysvetlenia prebiehajúceho deja pri zohrievaní a ochladzovaní banky so vzduchom by mali byť oveľa odbornejšie a smerujúce až k časticovej stavbe látok. Dokonca by mali navrhnúť spôsob zmerania hodnôt, prípadne úpravu zariadenia tak, aby bolo možné určiť prijaté teplo. Záverečná diskusia je aj testom učiteľovej práce.
Postup od konkrétnych, jedinečných výrokov k všeobecným súdom je postupom induktívnym. Zoradením aktivít, v ktorých žiaci uvažujú, pozorujú, vysvetľujú, merajú, spracúvajú namerané údaje a vyvodzujú závery, rozvíja u nich spôsobilosti vedeckej práce. Uvedené spôsobilosti sú v progresívnych obsahoch vyučovania fyziky ich integrálnou súčasťou, a preto keď sa zamýšľame nad tvorbou obsahu vyučovania, musíme mať na mysli aj ciele fyzikálneho vzdelávania, teda to, čo chceme prostredníctvom obsahu dosiahnuť.
Náročné fyzikálne pojmy nemožno zavádzať oznámením „vzorca“ a vyriešením niekoľkých príkladov na jeho využitie, ale prostredníctvom aktivít, v ktorých žiaci hľadajú a objavujú vzťahy a získavajú s daným pojmom skúsenosti. Rozčlenenie obsahu do jednotlivých krokov a vytvorenie aktivít pre žiakov tak, aby zodpovedali pravidlám induktívneho postupu, je úlohou didaktikov fyziky.
6.4.2 Deduktívny spôsob v téme o časticovej stavbe látok
Novým prístupom v súčasnom Štátnom vzdelávacom programe fyziky je aj vysvetľovanie javov na základe časticovej stavby látok. Zatiaľ čo v predchádzajúcej koncepcii už v 6. ročníku sa žiak učil o zložení atómu a vysvetľovaní javov na základe časticovej stavby látok, v súčasnej koncepcii sa k takémuto vysvetleniu dostáva neskôr. Dôraz je na postupnom prenikaní do podstaty javov cez pozorovanie vonkajších znakov, napr. zovšeobecnenie poznatku – deliteľnosť je všeobecná vlastnosť tuhých, kvapalných a plynných telies – žiak získa priamou skúsenosťou. Až po zavedení pojmu teplo a následným vysvetľovaním zmien štruktúry látky pri premenách skupenstva, učebnica prináša vysvetlenie založené na časticovej stavbe látok. Tomuto vysvetleniu však predchádza skúsenosť s meraním teploty v priebehu času pri premenách skupenstva kryštalických látok a následným spracovaním meraní do grafu. Pozorovanie reálneho priebehu premeny skupenstva a priebeh čiary grafu by malo žiakov upozorniť, že dodávané (odoberané) teplo spôsobuje premenu vnútornej štruktúry látky.
Vo fyzike vystačíme po 9. ročník s pojmami častica, atóm, molekula. Chémia zavádza stavbu atómu v 8. ročníku, a tak pri vysvetlení vzniku elektrického náboja, či definícii elektrického prúdu už možno pracovať s termínmi, ako je ión či elektrón, prípadne vysvetlením elektrickej vodivosti látok.
Aktivity 1 - 3 je potrebné brať ako celok, pretože sa viažu na spoločnú „teóriu“ o časticovej stavbe látok. Niektoré skúsenosti s delením látok, či experimentmi zaradenými do aktivít k téme 3 už žiaci zo základného obsahu vyučovania majú. Preto je možné sústrediť sa na overovanie vybraných výrokov teórie o časticovej stavbe látok a rozvoj deduktívneho myslenia žiakov. Žiakom možno pri predložených aktivitách ukázať ako pracujú vedci, ako sa tvorí a overuje vedecká teória. Treba však zdôrazniť, že ide o vybrané výroky teórie o časticovej stavbe látok, prispôsobenej teórie pre žiacke overovanie.
Cieľom aktivít je, aby žiak porozumel pojmu vedecká teória, pochopil proces overovania výrokov vedeckej teórie a rozvíjalo sa u neho deduktívne myslenie a procesy zovšeobecnenia pri dôkazoch časticovej stavby látok. V neposlednom rade by žiak mal byť schopný rozlíšiť pozorovanie od vysvetlenia a vedieť opísať svoju predstavu časticovej stavby tuhých látok. Okrem kognitívnych cieľov ide aj o napĺňanie afektívnych cieľov ako sú vyhľadávať a zaznamenávať si informácie, viesť diskusie a spolupracovať v tíme, porozumieť vplyvu technického pokroku na vedecké skúmania, kriticky vyhodnotiť kvalitu záverov z pozorovaní a ich vysvetlení jednotlivými. K psychomotorickým cieľom aktivít patrí vykonať pozorovania a vypracovať záznam o pozorovaní.
Skúsenosti s delením kvapalín by žiaci mali mať už zo 6. ročníka. Pri stanovišti 4 aktivity 2 by si však mali tiež všimnúť rozdiel medzi delením tuhých látok a kvapalín, ktoré možno ľahko opäť spojiť do jedného celku. Ide o upozornenie na inú kvalitu väzbových síl medzi časticami.
Elektrolýza vody je podrobne rozpísaná v učebnici fyziky pre 9. ročník (Lapitková, 2012, s. 87-88). Bolo by však dobré stanovište urobiť a na konci elektrolýzy dokázať plameňom prítomnosť kyslíka a vodíka. Na zápornom póle batérie sa vylučuje vodík, ktorý dokážeme tak, že odtlačkujeme hadičku na valci striekačky a priložíme zápalku. Plyn by mal šteknúť. Potom valce striekačiek nadvihneme a priložíme k valcu, ktorý bol položený na kladnom póle batérie, tlejúcu zápalku. Mala by sa rozhorieť.
Difúzia je jav málo zdôraznený v základnom obsahu fyziky pre 7. ročník (Lapitková, 2010b, s. 64). Preto je dôležité zaoberať sa týmto javom a v diskusii je možné spomenúť aj spôsob jeho objavenia Brownom.
Deliteľnosť, ako všeobecná vlastnosť tuhých, kvapalných a plynných látok, je obsahom fyziky už v 6. ročníku ZŠ. Na 7. stanovišti aktivity 3 sa opakuje delenie vzduchu, ktoré je uvedené aj v učebnici fyziky pre 6. ročník (Lapitková, 2010a, s. 27). Z dôvodu dodržania systematickosti je dôležité, aby sa realizoval aj pri tejto aktivite.
Difúzii, Brownovmu pohybu častíc, ako aj časticovému zloženiu látok vôbec, sa v obsahu fyziky na ZŠ nevenuje toľko priestoru ako v predchádzajúcej koncepcii. Preto práve pokusy s aromatickou látkou a difúziou plynov rozširujú vedomosti žiakov.
Žiacka verzia – Dôkazy časticovej stavby látok
Myšlienka o existencii atómov je veľmi stará. O atómoch už hovorili starovekí Gréci okolo r. 400 pred n. l. Atómová teória, súbor tvrdení, že látky sa skladajú z malých častíc, nazývaných atómy, je dnes už všeobecne prijatá. Pri riešení aktivít sa nebudeme pýtať či atómy jestvujú, budeme však pátrať po ich existencii a usilovať sa lepšie porozumieť časticovému zloženiu látky. Zároveň budeme napodobňovať prácu vedcov pri dokazovaní vybraných výrokov z atómovej teórie.
Teória je súbor tvrdení o predmete výskumu, ktoré v danej etape poznania považujeme za pravdivé. Vyžaduje sa, aby nebola v rozpore so súčasnými skúsenosťami a výsledkami experimentov. Teória je zovšeobecnením skúseností z praxe. Teória často predpovedá vlastnosti a javy, ktoré v čase formulovania teórie ešte neboli prakticky pozorované. Ak sa takéto predpovede potvrdia, je to silný dôkaz o pravdivosti teórie, ak sa nepotvrdia, tak je daná teória neplatná a musí sa preformulovať, alebo musí vzniknúť úplne nová teória.
Pre to, aby bola teória považovaná za vedeckú, musí spĺňať viacero kritérií. Napr. medzi kritéria vedeckej teórie patrí, že skúmaný jav má byť:
- vysvetľovaný čo najjednoduchším spôsobom,
- založený na kontrolovateľných a opakovateľných experimentoch alebo pozorovaniach.
Zostavili sme súbor vybraných výrokov do tzv. „atómovej teórie“, ktoré sa dajú overiť aj v školskom laboratóriu. Časticová stavba látok je predmetom skúmania chémie a fyziky. Vysvetľovanie niektorých javov napr. premeny skupenstva, elektrické javy či chemické vlastnosti látok spočívajú v časticovej stavbe látok.
Budeš sa zamýšľať nad úlohami zadávanými na jednotlivých stanovištiach. Na stanovištiach sú potrebné pomôcky. Podľa návodu vykonaj činnosti, zaznamenaj pozorovania a vysvetlenia. Závery, ktoré si poznačíš do tabuľky 6.2, sa budú týkať aj výrokov, ktoré sú vybrané pre školské skúmanie a majú byť výsledkom diskusie v skupine.
Vybrané výroky atómovej teórie:
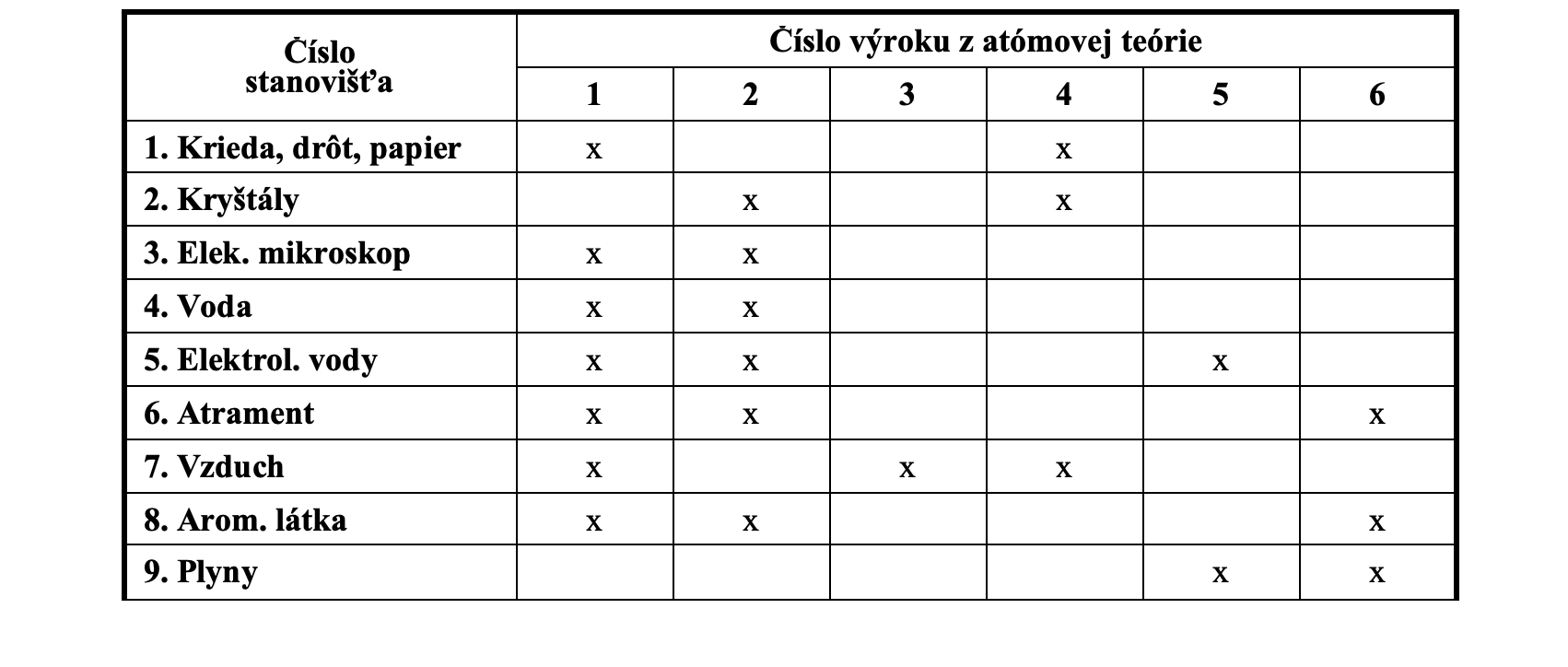
1. Telesá z rozličných látok možno rozdeliť na menšie časti.
2. Každá látka je zložená z malých neviditeľných častíc nazývaných atómy.
3. Atómy toho istého prvku majú rovnaké vlastnosti.
4. Atómy rôznych prvkov majú rôzne vlastnosti.
5. Atómy tvoria zlúčeniny v pomere celých čísel.
6. Častice látky sa ustavične neusporiadane pohybujú.
Tabuľka 6.2 Overovanie vybraných výrokov atómovej teórie
Práca sa koná v gravitačnom poli Zeme, broky padajú kolmo k zemi. Potrebujeme zmerať počiatočnú teplotu brokov, dĺžku trubice a po niekoľkonásobnom počte otočení trubice (30, 60, 90) aj výslednú teplotu brokov. Vypočíta sa vykonaná práca (J) a vyprodukované teplo (cal). Výpočtom alebo pomocou grafu, možno zistiť prácu potrebnú na vyprodukovanie tepla 1 cal. S veľkou pravdepodobnosťou sa nepodarí v školských podmienkach určiť presne vzťah 1 cal = 4,18 J, podarí sa však ukázať cestu, ako sa k hodnote 4,18 dospelo.
Dôležité je žiakom ukázať aj praktickú využiteľnosť určenia hodnoty prijatého či odovzdaného tepla, a to na príklade zisťovania energie potravín, čo možno pokusne ukázať v pokuse so spaľovaním orieška, ktorý odovzdáva teplo vode.
Na záver by sa mali žiaci opäť vrátiť k modelu Galileovho termoskopu. Očakávame, že ich vysvetlenia prebiehajúceho deja pri zohrievaní a ochladzovaní banky so vzduchom by mali byť oveľa odbornejšie a smerujúce až k časticovej stavbe látok. Dokonca by mali navrhnúť spôsob zmerania hodnôt, prípadne úpravu zariadenia tak, aby bolo možné určiť prijaté teplo. Záverečná diskusia je aj testom učiteľovej práce.
Postup od konkrétnych, jedinečných výrokov k všeobecným súdom je postupom induktívnym. Zoradením aktivít, v ktorých žiaci uvažujú, pozorujú, vysvetľujú, merajú, spracúvajú namerané údaje a vyvodzujú závery, rozvíja u nich spôsobilosti vedeckej práce. Uvedené spôsobilosti sú v progresívnych obsahoch vyučovania fyziky ich integrálnou súčasťou, a preto keď sa zamýšľame nad tvorbou obsahu vyučovania, musíme mať na mysli aj ciele fyzikálneho vzdelávania, teda to, čo chceme prostredníctvom obsahu dosiahnuť.
Náročné fyzikálne pojmy nemožno zavádzať oznámením „vzorca“ a vyriešením niekoľkých príkladov na jeho využitie, ale prostredníctvom aktivít, v ktorých žiaci hľadajú a objavujú vzťahy a získavajú s daným pojmom skúsenosti. Rozčlenenie obsahu do jednotlivých krokov a vytvorenie aktivít pre žiakov tak, aby zodpovedali pravidlám induktívneho postupu, je úlohou didaktikov fyziky.
6.4.2 Deduktívny spôsob v téme o časticovej stavbe látok
Novým prístupom v súčasnom Štátnom vzdelávacom programe fyziky je aj vysvetľovanie javov na základe časticovej stavby látok. Zatiaľ čo v predchádzajúcej koncepcii už v 6. ročníku sa žiak učil o zložení atómu a vysvetľovaní javov na základe časticovej stavby látok, v súčasnej koncepcii sa k takémuto vysvetleniu dostáva neskôr. Dôraz je na postupnom prenikaní do podstaty javov cez pozorovanie vonkajších znakov, napr. zovšeobecnenie poznatku – deliteľnosť je všeobecná vlastnosť tuhých, kvapalných a plynných telies – žiak získa priamou skúsenosťou. Až po zavedení pojmu teplo a následným vysvetľovaním zmien štruktúry látky pri premenách skupenstva, učebnica prináša vysvetlenie založené na časticovej stavbe látok. Tomuto vysvetleniu však predchádza skúsenosť s meraním teploty v priebehu času pri premenách skupenstva kryštalických látok a následným spracovaním meraní do grafu. Pozorovanie reálneho priebehu premeny skupenstva a priebeh čiary grafu by malo žiakov upozorniť, že dodávané (odoberané) teplo spôsobuje premenu vnútornej štruktúry látky.
Vo fyzike vystačíme po 9. ročník s pojmami častica, atóm, molekula. Chémia zavádza stavbu atómu v 8. ročníku, a tak pri vysvetlení vzniku elektrického náboja, či definícii elektrického prúdu už možno pracovať s termínmi, ako je ión či elektrón, prípadne vysvetlením elektrickej vodivosti látok.
Aktivity 1 - 3 je potrebné brať ako celok, pretože sa viažu na spoločnú „teóriu“ o časticovej stavbe látok. Niektoré skúsenosti s delením látok, či experimentmi zaradenými do aktivít k téme 3 už žiaci zo základného obsahu vyučovania majú. Preto je možné sústrediť sa na overovanie vybraných výrokov teórie o časticovej stavbe látok a rozvoj deduktívneho myslenia žiakov. Žiakom možno pri predložených aktivitách ukázať ako pracujú vedci, ako sa tvorí a overuje vedecká teória. Treba však zdôrazniť, že ide o vybrané výroky teórie o časticovej stavbe látok, prispôsobenej teórie pre žiacke overovanie.
Cieľom aktivít je, aby žiak porozumel pojmu vedecká teória, pochopil proces overovania výrokov vedeckej teórie a rozvíjalo sa u neho deduktívne myslenie a procesy zovšeobecnenia pri dôkazoch časticovej stavby látok. V neposlednom rade by žiak mal byť schopný rozlíšiť pozorovanie od vysvetlenia a vedieť opísať svoju predstavu časticovej stavby tuhých látok. Okrem kognitívnych cieľov ide aj o napĺňanie afektívnych cieľov ako sú vyhľadávať a zaznamenávať si informácie, viesť diskusie a spolupracovať v tíme, porozumieť vplyvu technického pokroku na vedecké skúmania, kriticky vyhodnotiť kvalitu záverov z pozorovaní a ich vysvetlení jednotlivými. K psychomotorickým cieľom aktivít patrí vykonať pozorovania a vypracovať záznam o pozorovaní.
Skúsenosti s delením kvapalín by žiaci mali mať už zo 6. ročníka. Pri stanovišti 4 aktivity 2 by si však mali tiež všimnúť rozdiel medzi delením tuhých látok a kvapalín, ktoré možno ľahko opäť spojiť do jedného celku. Ide o upozornenie na inú kvalitu väzbových síl medzi časticami.
Elektrolýza vody je podrobne rozpísaná v učebnici fyziky pre 9. ročník (Lapitková, 2012, s. 87-88). Bolo by však dobré stanovište urobiť a na konci elektrolýzy dokázať plameňom prítomnosť kyslíka a vodíka. Na zápornom póle batérie sa vylučuje vodík, ktorý dokážeme tak, že odtlačkujeme hadičku na valci striekačky a priložíme zápalku. Plyn by mal šteknúť. Potom valce striekačiek nadvihneme a priložíme k valcu, ktorý bol položený na kladnom póle batérie, tlejúcu zápalku. Mala by sa rozhorieť.
Difúzia je jav málo zdôraznený v základnom obsahu fyziky pre 7. ročník (Lapitková, 2010b, s. 64). Preto je dôležité zaoberať sa týmto javom a v diskusii je možné spomenúť aj spôsob jeho objavenia Brownom.
Deliteľnosť, ako všeobecná vlastnosť tuhých, kvapalných a plynných látok, je obsahom fyziky už v 6. ročníku ZŠ. Na 7. stanovišti aktivity 3 sa opakuje delenie vzduchu, ktoré je uvedené aj v učebnici fyziky pre 6. ročník (Lapitková, 2010a, s. 27). Z dôvodu dodržania systematickosti je dôležité, aby sa realizoval aj pri tejto aktivite.
Difúzii, Brownovmu pohybu častíc, ako aj časticovému zloženiu látok vôbec, sa v obsahu fyziky na ZŠ nevenuje toľko priestoru ako v predchádzajúcej koncepcii. Preto práve pokusy s aromatickou látkou a difúziou plynov rozširujú vedomosti žiakov.
Žiacka verzia – Dôkazy časticovej stavby látok
Myšlienka o existencii atómov je veľmi stará. O atómoch už hovorili starovekí Gréci okolo r. 400 pred n. l. Atómová teória, súbor tvrdení, že látky sa skladajú z malých častíc, nazývaných atómy, je dnes už všeobecne prijatá. Pri riešení aktivít sa nebudeme pýtať či atómy jestvujú, budeme však pátrať po ich existencii a usilovať sa lepšie porozumieť časticovému zloženiu látky. Zároveň budeme napodobňovať prácu vedcov pri dokazovaní vybraných výrokov z atómovej teórie.
Teória je súbor tvrdení o predmete výskumu, ktoré v danej etape poznania považujeme za pravdivé. Vyžaduje sa, aby nebola v rozpore so súčasnými skúsenosťami a výsledkami experimentov. Teória je zovšeobecnením skúseností z praxe. Teória často predpovedá vlastnosti a javy, ktoré v čase formulovania teórie ešte neboli prakticky pozorované. Ak sa takéto predpovede potvrdia, je to silný dôkaz o pravdivosti teórie, ak sa nepotvrdia, tak je daná teória neplatná a musí sa preformulovať, alebo musí vzniknúť úplne nová teória.
Pre to, aby bola teória považovaná za vedeckú, musí spĺňať viacero kritérií. Napr. medzi kritéria vedeckej teórie patrí, že skúmaný jav má byť:
- vysvetľovaný čo najjednoduchším spôsobom,
- založený na kontrolovateľných a opakovateľných experimentoch alebo pozorovaniach.
Zostavili sme súbor vybraných výrokov do tzv. „atómovej teórie“, ktoré sa dajú overiť aj v školskom laboratóriu. Časticová stavba látok je predmetom skúmania chémie a fyziky. Vysvetľovanie niektorých javov napr. premeny skupenstva, elektrické javy či chemické vlastnosti látok spočívajú v časticovej stavbe látok.
Budeš sa zamýšľať nad úlohami zadávanými na jednotlivých stanovištiach. Na stanovištiach sú potrebné pomôcky. Podľa návodu vykonaj činnosti, zaznamenaj pozorovania a vysvetlenia. Závery, ktoré si poznačíš do tabuľky 6.2, sa budú týkať aj výrokov, ktoré sú vybrané pre školské skúmanie a majú byť výsledkom diskusie v skupine.
Vybrané výroky atómovej teórie:
1. Telesá z rozličných látok možno rozdeliť na menšie časti.
2. Každá látka je zložená z malých neviditeľných častíc nazývaných atómy.
3. Atómy toho istého prvku majú rovnaké vlastnosti.
4. Atómy rôznych prvkov majú rôzne vlastnosti.
5. Atómy tvoria zlúčeniny v pomere celých čísel.
6. Častice látky sa ustavične neusporiadane pohybujú.
Tabuľka 6.2 Overovanie vybraných výrokov atómovej teórie
 Názov aktivity 1– Pozorovanie tuhých látok
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre tuhé látky
Pomôcky:
Stanovište č. 1 – Petriho miska, krieda, nôž z plastu, nožnice, tenký medený drôt, hárok papiera (obr. 6.8)
Stanovište č. 2 – vypestované kryštály modrej skalice, soli a cukru, lupa (obr. 6.9)
Stanovište č. 3 – obrázky z elektrónového mikroskopu povrchu tuhej látky (uhlík) (obr. 6.10)
Postup práce:
Stanovište č. 1 Pozorovanie delenia kriedy, drôtu a papiera
1. Rozdeľ kriedu nožom z plastu v Petriho miske na malé kúsky.
2. Strihaj medený drôt na malé časti.
3. Strihaj papier na malé časti.
4. Zaznamenaj si do tabuľky svoje pozorovania, ich vysvetlenia a číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 1. (Pred opustením stanovišťa odprac nastrihané kúsky.)
Názov aktivity 1– Pozorovanie tuhých látok
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre tuhé látky
Pomôcky:
Stanovište č. 1 – Petriho miska, krieda, nôž z plastu, nožnice, tenký medený drôt, hárok papiera (obr. 6.8)
Stanovište č. 2 – vypestované kryštály modrej skalice, soli a cukru, lupa (obr. 6.9)
Stanovište č. 3 – obrázky z elektrónového mikroskopu povrchu tuhej látky (uhlík) (obr. 6.10)
Postup práce:
Stanovište č. 1 Pozorovanie delenia kriedy, drôtu a papiera
1. Rozdeľ kriedu nožom z plastu v Petriho miske na malé kúsky.
2. Strihaj medený drôt na malé časti.
3. Strihaj papier na malé časti.
4. Zaznamenaj si do tabuľky svoje pozorovania, ich vysvetlenia a číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 1. (Pred opustením stanovišťa odprac nastrihané kúsky.)
 Stanovište č. 2 Pozorovanie kryštálov
1. Na stanovišti sú kryštály modrej skalice, cukru a soli. Pozoruj kryštály aj pomocou lupy.
2. Zaznamenaj si do tabuľky svoje pozorovania, ich vysvetlenia a číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 2.
Stanovište č. 2 Pozorovanie kryštálov
1. Na stanovišti sú kryštály modrej skalice, cukru a soli. Pozoruj kryštály aj pomocou lupy.
2. Zaznamenaj si do tabuľky svoje pozorovania, ich vysvetlenia a číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 2.
 Stanovište č. 3 Pozorovanie povrchu uhlíka na obrázkoch z elektrónového mikroskopu
Na vedecké účely sa konštruujú mikroskopy, ktoré pri zobrazovaní využívajú aj iné fyzikálne javy ako viditeľné svetlo. Tak napr. v elektrónových mikroskopoch sa na zobrazovanie predmetov využíva vychyľovanie rýchle sa pohybujúcich častíc – elektrónov. Elektrónový mikroskop umožňuje miliónkrát zväčšiť obraz pozorovaného predmetu. Na obrázku je fotografia elektrónového mikroskopu a ukážky pozorovaní elektrónovým mikroskopom, získané v laboratóriách Fakulty matematiky, fyziky a informatiky UK v Bratislave.
Vďaka elektrónovým mikroskopom fyzika získava dôležité a stále nové informácie o stavbe látok. V učebnici fyziky pre 6. ročník ste mali možnosť vidieť obrázky povrchu uhlíka. Biela bodka na obrázku, kde vidieť šupinky povrchu uhlíka, je po milión násobnom zväčšení zobrazená úplne vpravo.
Stanovište č. 3 Pozorovanie povrchu uhlíka na obrázkoch z elektrónového mikroskopu
Na vedecké účely sa konštruujú mikroskopy, ktoré pri zobrazovaní využívajú aj iné fyzikálne javy ako viditeľné svetlo. Tak napr. v elektrónových mikroskopoch sa na zobrazovanie predmetov využíva vychyľovanie rýchle sa pohybujúcich častíc – elektrónov. Elektrónový mikroskop umožňuje miliónkrát zväčšiť obraz pozorovaného predmetu. Na obrázku je fotografia elektrónového mikroskopu a ukážky pozorovaní elektrónovým mikroskopom, získané v laboratóriách Fakulty matematiky, fyziky a informatiky UK v Bratislave.
Vďaka elektrónovým mikroskopom fyzika získava dôležité a stále nové informácie o stavbe látok. V učebnici fyziky pre 6. ročník ste mali možnosť vidieť obrázky povrchu uhlíka. Biela bodka na obrázku, kde vidieť šupinky povrchu uhlíka, je po milión násobnom zväčšení zobrazená úplne vpravo.
 1. Zamysli sa nad obrázkami z elektrónového mikroskopu a zaznamenaj do tabuľky v časti pozorovanie svoj názor, čo zachytil elektrónový mikroskop na povrchu uhlíka.
2. Vo vysvetlení hľadaj argumenty pre svoje tvrdenia. Zapíš si číslo výroku z atómovej teórie do tabuľky.
Zhrňujúce otázky:
1. Ktoré z overovaných výrokov sa pri pozorovaní tuhých látok potvrdili na všetkých troch stanovištiach?
2. Ktoré výroky atómovej teórie skúma chémia?
3. Čo určuje tvar kryštálov?
4. Ktorý technický vynález prispel k potvrdeniu atómovej teórie? Vysvetli svoje tvrdenie.
5. Prezentuj svoje závery z pozorovaní pred triedou. Ktorá skupina vysvetlila svoje pozorovania najlepšie?
Učiteľská verzia k aktivite 1
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre tuhé látky.
Vysvetlenie obsahu aktivity:
Pri realizácii aktivity môže vyučujúci rozšíriť obsah vyučovania, a to v časti vznik kryštálov a získania informácií o elektrónovom mikroskope. Vznik kryštálov by si mali žiaci jednak naštudovať, ale tiež nechať vykryštalizovať nasýtené roztoky cukru či soli ako domácu úlohu.
Kryštály z modrej skalice je potrebné urobiť v školskom laboratóriu nasledovným postupom:
- rozpustiť modrú skalicu v čo najmenšom množstve horúcej vody, urobiť nasýtený roztok,
- vyliať roztok do Petriho misky a dať odparovať na stabilné, nie veľmi teplé miesto,
- po čase sterilným spôsobom vybrať z misky najkrajší kryštál a preložiť do čistej misky, opäť zaliať nasýteným roztokom modrej skalice a nechať na pokojnom mieste kryštalizovať,
- z konečných kryštálov obrúsiť nepravidelnosti.
Kryštalizácia môže byť podnetná pre nasledovné otázky, ktoré zadáme žiakom:
1. Aké podmienky určujú veľkosť kryštálu modrej skalice?
2. Vieme pri kryštalizácii nájsť dôkazy, že sa látky skladajú z častíc?
Pri stanovišti s elektrónovým mikroskopom by mala vyniknúť myšlienka – technické vynálezy posúvajú dopredu vedecké skúmania.
Vyučujúci pripraví 3 stanovištia s pomôckami uvedenými v žiackej verzii. 2 stanovištia sú zložené z reálnych pomôcok, súčasťou tretieho sú obrázky z elektrónového mikroskopu, prípadne počítač s obrázkami. Žiaci by mali pracovať v skupinách, prípadne vo dvojiciach, a preto by mohli byť niektoré stanovištia 2x. Zároveň každý žiak by mal mať vytlačenú tabuľku Overovanie vybraných výrokov atómovej teórie. Na stanovištia odporúčame dať opis aktivity so žiackej verzii a zoznamom výrokov atómovej teórie, ktoré majú žiaci overovať.
Žiaci by mali postupne prechádzať stanovišťami a vykonať na nich potrebné činnosti. Poradie navštívených stanovíšť nie je rozhodujúce.
Záver hodiny je potrebné venovať prezentácii výsledkov skupín a diskusii, ktorá vedie k zovšeobecneniu o časticovej stavbe tuhých látok.
Zhrňujúce otázky:
1. Otázka smeruje k záverečnému zovšeobecneniu. Pre všetky stanovištia platí výrok 2.
2. Ide predovšetkým o výrok 5.
3. Potvrdenie výrokov 3, 4.
4. Diskusia by mala byť zameraná predovšetkým na elektrónový mikroskop.
Názov aktivity 2 – Pozorovanie kvapalín
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre kvapaliny.
Pomôcky:
Stanovište č. 4 – Petriho miska, nôž z plastu, nádoba s vodou, kvapkadlo, utierka (obr. 6.11)
Stanovište č. 5 – batéria (9 V), 3 injekčné striekačky s objemom 20 ml, malé akvárium, 2 tlačky, tenký drôt, plastová hadička 8 cm, stojan so svorkami, kryštalická sóda (Lapitková, 2012, s. 87) (obr. 6.12)
Stanovište č. 6 – atrament, kvapkadlo, voda, kadička 50 ml (obr. 6.13)
Postup práce:
Stanovište č. 4 Pozorovanie delenia vody
1. Nakvapkaj niekoľko kvapiek vody na suchú Petriho misku.
2. Snaž sa plastovým nožom rozdeliť väčšiu kvapku na menšie.
3. Spoj menšie kvapky do jednej väčšej.
4. Zaznamenaj si do tabuľky svoje pozorovania, ich vysvetlenia a číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 4. (Daj stanovište pred opustením do pôvodného stavu.)
1. Zamysli sa nad obrázkami z elektrónového mikroskopu a zaznamenaj do tabuľky v časti pozorovanie svoj názor, čo zachytil elektrónový mikroskop na povrchu uhlíka.
2. Vo vysvetlení hľadaj argumenty pre svoje tvrdenia. Zapíš si číslo výroku z atómovej teórie do tabuľky.
Zhrňujúce otázky:
1. Ktoré z overovaných výrokov sa pri pozorovaní tuhých látok potvrdili na všetkých troch stanovištiach?
2. Ktoré výroky atómovej teórie skúma chémia?
3. Čo určuje tvar kryštálov?
4. Ktorý technický vynález prispel k potvrdeniu atómovej teórie? Vysvetli svoje tvrdenie.
5. Prezentuj svoje závery z pozorovaní pred triedou. Ktorá skupina vysvetlila svoje pozorovania najlepšie?
Učiteľská verzia k aktivite 1
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre tuhé látky.
Vysvetlenie obsahu aktivity:
Pri realizácii aktivity môže vyučujúci rozšíriť obsah vyučovania, a to v časti vznik kryštálov a získania informácií o elektrónovom mikroskope. Vznik kryštálov by si mali žiaci jednak naštudovať, ale tiež nechať vykryštalizovať nasýtené roztoky cukru či soli ako domácu úlohu.
Kryštály z modrej skalice je potrebné urobiť v školskom laboratóriu nasledovným postupom:
- rozpustiť modrú skalicu v čo najmenšom množstve horúcej vody, urobiť nasýtený roztok,
- vyliať roztok do Petriho misky a dať odparovať na stabilné, nie veľmi teplé miesto,
- po čase sterilným spôsobom vybrať z misky najkrajší kryštál a preložiť do čistej misky, opäť zaliať nasýteným roztokom modrej skalice a nechať na pokojnom mieste kryštalizovať,
- z konečných kryštálov obrúsiť nepravidelnosti.
Kryštalizácia môže byť podnetná pre nasledovné otázky, ktoré zadáme žiakom:
1. Aké podmienky určujú veľkosť kryštálu modrej skalice?
2. Vieme pri kryštalizácii nájsť dôkazy, že sa látky skladajú z častíc?
Pri stanovišti s elektrónovým mikroskopom by mala vyniknúť myšlienka – technické vynálezy posúvajú dopredu vedecké skúmania.
Vyučujúci pripraví 3 stanovištia s pomôckami uvedenými v žiackej verzii. 2 stanovištia sú zložené z reálnych pomôcok, súčasťou tretieho sú obrázky z elektrónového mikroskopu, prípadne počítač s obrázkami. Žiaci by mali pracovať v skupinách, prípadne vo dvojiciach, a preto by mohli byť niektoré stanovištia 2x. Zároveň každý žiak by mal mať vytlačenú tabuľku Overovanie vybraných výrokov atómovej teórie. Na stanovištia odporúčame dať opis aktivity so žiackej verzii a zoznamom výrokov atómovej teórie, ktoré majú žiaci overovať.
Žiaci by mali postupne prechádzať stanovišťami a vykonať na nich potrebné činnosti. Poradie navštívených stanovíšť nie je rozhodujúce.
Záver hodiny je potrebné venovať prezentácii výsledkov skupín a diskusii, ktorá vedie k zovšeobecneniu o časticovej stavbe tuhých látok.
Zhrňujúce otázky:
1. Otázka smeruje k záverečnému zovšeobecneniu. Pre všetky stanovištia platí výrok 2.
2. Ide predovšetkým o výrok 5.
3. Potvrdenie výrokov 3, 4.
4. Diskusia by mala byť zameraná predovšetkým na elektrónový mikroskop.
Názov aktivity 2 – Pozorovanie kvapalín
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre kvapaliny.
Pomôcky:
Stanovište č. 4 – Petriho miska, nôž z plastu, nádoba s vodou, kvapkadlo, utierka (obr. 6.11)
Stanovište č. 5 – batéria (9 V), 3 injekčné striekačky s objemom 20 ml, malé akvárium, 2 tlačky, tenký drôt, plastová hadička 8 cm, stojan so svorkami, kryštalická sóda (Lapitková, 2012, s. 87) (obr. 6.12)
Stanovište č. 6 – atrament, kvapkadlo, voda, kadička 50 ml (obr. 6.13)
Postup práce:
Stanovište č. 4 Pozorovanie delenia vody
1. Nakvapkaj niekoľko kvapiek vody na suchú Petriho misku.
2. Snaž sa plastovým nožom rozdeliť väčšiu kvapku na menšie.
3. Spoj menšie kvapky do jednej väčšej.
4. Zaznamenaj si do tabuľky svoje pozorovania, ich vysvetlenia a číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 4. (Daj stanovište pred opustením do pôvodného stavu.)
 Stanovište č. 5 Pozorovanie elektrolýzy vody
1. Na stanovišti prebieha elektrolýza vody. Pozoruj čo sa deje na póloch batérie.
2. Aký plyn sa vyvíja na kladnom a na zápornom póle batérie? Urob predpoklad.
3. Zaznamenaj si do tabuľky svoje pozorovania, predpoklad a vysvetlenie diania na póloch batérie. Zapíš si číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 5.
Stanovište č. 5 Pozorovanie elektrolýzy vody
1. Na stanovišti prebieha elektrolýza vody. Pozoruj čo sa deje na póloch batérie.
2. Aký plyn sa vyvíja na kladnom a na zápornom póle batérie? Urob predpoklad.
3. Zaznamenaj si do tabuľky svoje pozorovania, predpoklad a vysvetlenie diania na póloch batérie. Zapíš si číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 5.
 Stanovište č. 6 Pozorovanie kvapiek atramentu vo vode
1. Kvapni pipetou kvapku atramentu do kadičky s vodou.
2. Chvíľu pozoruj správanie kvapky.
3. Zapíš si pozorovanie a vysvetlenie správania kvapky. Zapíš si do tabuľky číslo výroku z atómovej teórie, ktorý pokus dokazuje. (Daj stanovište pred opustením do pôvodného stavu.)
Stanovište č. 6 Pozorovanie kvapiek atramentu vo vode
1. Kvapni pipetou kvapku atramentu do kadičky s vodou.
2. Chvíľu pozoruj správanie kvapky.
3. Zapíš si pozorovanie a vysvetlenie správania kvapky. Zapíš si do tabuľky číslo výroku z atómovej teórie, ktorý pokus dokazuje. (Daj stanovište pred opustením do pôvodného stavu.)
 Zhrňujúce otázky:
1. Ktoré z overovaných výrokov sa pri pozorovaní kvapalín potvrdili na všetkých troch stanovištiach?
2. Aké vlastnosti látky, atómov (molekúl), možno zaznamenať pri pozorovaní delenia vody? Rovnako sa správali aj tuhé látky?
3. Aké vlastnosti látok, atómov, možno zaznamenať pozorovaním elektrolýzy vody? Ktoré látky vznikajú pri elektrolýze vody? Odkiaľ sa zobrali?
4. Aké vlastnosti častíc dokazuje správanie sa atramentu vo vode po dlhšej dobe?
5. Prezentuj svoje závery z pozorovaní pred triedou. Ktorá skupina vysvetlila svoje pozorovania najlepšie?
Učiteľská verzia k aktivite 2
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre kvapaliny.
Vysvetlenie obsahu aktivity:
Pozorovanie delenia kvapky je založené na analýze vonkajších prejavov kvapaliny. Žiaci na suchú Petriho misku nakvapkali niekoľko kvapiek vody. Delili a spájali kvapky vody nožom z plastu. Dôležité je zistenie, že kvapalinu ľahko rozdelili na niekoľko častí a následne dokázali spojiť do jednej veľkej kvapky.
Molekuly kvapalín držia pohromade určitými silami, ktoré sa dajú ľahko prekonať. Tým môžeme kvapaliny rozdeliť na menšie časti. Príkladom sú aj rôzne spreje naplnené kvapalinami, ktoré stlačením pumpičky ľahko rozprášime na drobné kvapôčky.
Vysvetlenie je v medzimolekulových silách, presnejšie (čo žiaci nemusia vedieť) medzimolekulových väzbových silách: van der Waalsové sily a vodíková väzba. Van der Waalsové sily sú veľmi slabé, a ich podstatou je elektrostatické medzimolekulové pôsobenie. Podstatou vodíkovej väzby, ktorá je omnoho silnejšia, sú príťažlivé sily medzi kladným a záporným čiastkovým nábojom polárnych molekúl. Molekuly musia obsahovať atóm vodíka viazaný na atóm s veľkou hodnotou elektronegativity.
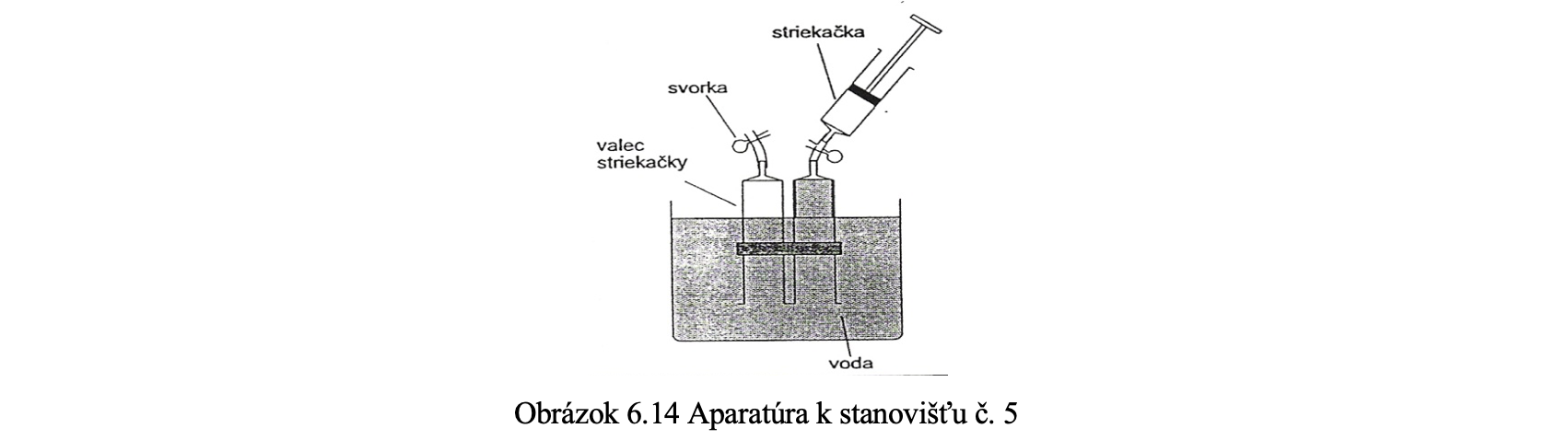
Cieľom aktivity na stanovišti 4 je uskutočniť elektrolýzu vody a potvrdiť vyvíjanie vodíka na katóde a kyslíka na anóde. Elektrolýza je rozklad vody (H2O) na molekuly kyslíka a vodíka v dôsledku pôsobenia elektrického prúdu preneseného cez vodu. Malá časť molekúl vody je rozštiepená na ióny, a preto sa do vody pridáva obyčajne malé množstvo kryštalickej sódy na pranie (Na2CO3), ale aj napr. kyselina sírová. Pri reakcií s vodou sa uvoľňujú molekuly kyslíka O2. Vložili sme do kvapaliny 9 V batériu a dva valce striekačiek naplnené vodou sme položili nad katódu aj anódu. Počas reakcie sa nám uvoľňoval na kladnej elektróde kyslík a na zápornej elektróde vodík a tieto plyny vytláčali zo striekačiek vodu. Už na prvý pohľad si žiaci mohli všimnúť, že jedného plynu je viac ako druhého. Keďže sa rozkladala voda, molekúl vodíka sme zachytili v striekačke viac ako molekúl kyslíka. Pomer vodíka a kyslíka je 2 : 1, čo možno odčítať na stupnici striekačiek. Pri tomto pokuse sa dokázal výrok 5 – Atómy tvoria zlúčeniny v pomere celých čísel.
Pri príprave aparatúry je potrebné valce striekačiek naplniť vodou, ktorú pri elektrolýze vytláčajú plyny. Na obrázku 6.14 je znázornený spôsob ako valce vodou naplniť.
Zhrňujúce otázky:
1. Ktoré z overovaných výrokov sa pri pozorovaní kvapalín potvrdili na všetkých troch stanovištiach?
2. Aké vlastnosti látky, atómov (molekúl), možno zaznamenať pri pozorovaní delenia vody? Rovnako sa správali aj tuhé látky?
3. Aké vlastnosti látok, atómov, možno zaznamenať pozorovaním elektrolýzy vody? Ktoré látky vznikajú pri elektrolýze vody? Odkiaľ sa zobrali?
4. Aké vlastnosti častíc dokazuje správanie sa atramentu vo vode po dlhšej dobe?
5. Prezentuj svoje závery z pozorovaní pred triedou. Ktorá skupina vysvetlila svoje pozorovania najlepšie?
Učiteľská verzia k aktivite 2
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre kvapaliny.
Vysvetlenie obsahu aktivity:
Pozorovanie delenia kvapky je založené na analýze vonkajších prejavov kvapaliny. Žiaci na suchú Petriho misku nakvapkali niekoľko kvapiek vody. Delili a spájali kvapky vody nožom z plastu. Dôležité je zistenie, že kvapalinu ľahko rozdelili na niekoľko častí a následne dokázali spojiť do jednej veľkej kvapky.
Molekuly kvapalín držia pohromade určitými silami, ktoré sa dajú ľahko prekonať. Tým môžeme kvapaliny rozdeliť na menšie časti. Príkladom sú aj rôzne spreje naplnené kvapalinami, ktoré stlačením pumpičky ľahko rozprášime na drobné kvapôčky.
Vysvetlenie je v medzimolekulových silách, presnejšie (čo žiaci nemusia vedieť) medzimolekulových väzbových silách: van der Waalsové sily a vodíková väzba. Van der Waalsové sily sú veľmi slabé, a ich podstatou je elektrostatické medzimolekulové pôsobenie. Podstatou vodíkovej väzby, ktorá je omnoho silnejšia, sú príťažlivé sily medzi kladným a záporným čiastkovým nábojom polárnych molekúl. Molekuly musia obsahovať atóm vodíka viazaný na atóm s veľkou hodnotou elektronegativity.
Cieľom aktivity na stanovišti 4 je uskutočniť elektrolýzu vody a potvrdiť vyvíjanie vodíka na katóde a kyslíka na anóde. Elektrolýza je rozklad vody (H2O) na molekuly kyslíka a vodíka v dôsledku pôsobenia elektrického prúdu preneseného cez vodu. Malá časť molekúl vody je rozštiepená na ióny, a preto sa do vody pridáva obyčajne malé množstvo kryštalickej sódy na pranie (Na2CO3), ale aj napr. kyselina sírová. Pri reakcií s vodou sa uvoľňujú molekuly kyslíka O2. Vložili sme do kvapaliny 9 V batériu a dva valce striekačiek naplnené vodou sme položili nad katódu aj anódu. Počas reakcie sa nám uvoľňoval na kladnej elektróde kyslík a na zápornej elektróde vodík a tieto plyny vytláčali zo striekačiek vodu. Už na prvý pohľad si žiaci mohli všimnúť, že jedného plynu je viac ako druhého. Keďže sa rozkladala voda, molekúl vodíka sme zachytili v striekačke viac ako molekúl kyslíka. Pomer vodíka a kyslíka je 2 : 1, čo možno odčítať na stupnici striekačiek. Pri tomto pokuse sa dokázal výrok 5 – Atómy tvoria zlúčeniny v pomere celých čísel.
Pri príprave aparatúry je potrebné valce striekačiek naplniť vodou, ktorú pri elektrolýze vytláčajú plyny. Na obrázku 6.14 je znázornený spôsob ako valce vodou naplniť.
 Na stanovišti č. 6 je úlohou žiakov analyzovať správanie sa farebnej kvapaliny (najlepšie atramentu) vo vode. Žiaci kvapnú kvapkadlom (pipetou) kvapku atramentu do kadičky s vodou. Kvapalinu nechajú na pokojnom mieste a chvíľu pozorujú jej správanie. Po pozorovaní si zaznamenajú svoje postrehy do tabuľky. Daná aktivita potvrdzuje výrok č. 6 – Častice látky sa ustavične neusporiadane pohybujú.
Všetky tekutiny majú tendenciu prechádzať z prostredia s vyššou koncentráciou do prostredia s nižšou koncentráciou. Prirodzenou vlastnosťou tekutín je, že sa rozptyľujú do celého priestoru, a postupne vo všetkých jeho častiach vyrovnajú svoju koncentráciu. Hovoríme, že látky difundujú.
Pre urýchlenie pozorovania môžeme dať na stanovište 2 kadičky. V jednej budú žiaci pozorovať kvapnutie atramentu a druhá bude stabilne položená na stanovišti ako vzor difúzie častíc atramentu do celého priestoru po dlhšom čase.
Zhrňujúce otázky:
1. Otázka smeruje k záverečnému zovšeobecneniu. Pre všetky stanovištia platí výrok 1.
2. Zdôrazniť by sa mali rozdiely medzi tuhými látkami a kvapalinami, väzby medzi časticami. Dôsledkom iného druhu väzieb pri kvapalinách je opätovné spájanie kvapiek do jedného celku.
3. Potvrdenie výrokov 4, 5. Na rozklad chemickej väzby je potrebná energia (elektrická). Voda sa rozložila na kyslík a vodík.
4. Potvrdenie výroku 6.
Názov aktivity 3 – Pozorovanie plynov
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre plyny
Pomôcky:
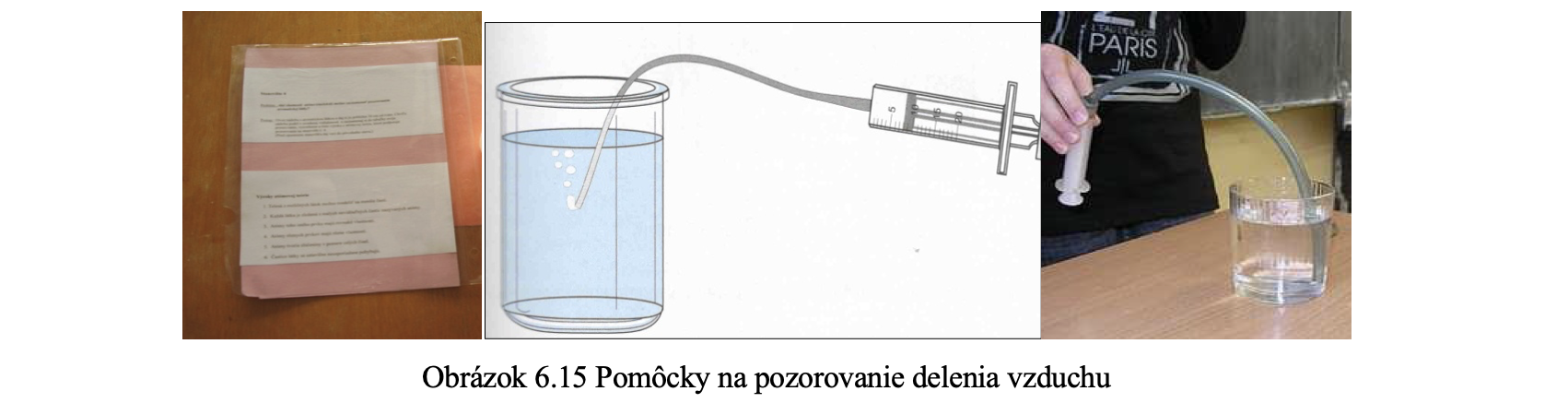
Stanovište č. 7 – kadička, striekačka, hadička z plastu, voda (obr. 6.15)
Stanovište č. 8 – aromatická kvapalina uzavretá v nádobe (voňavka, zriedený čpavok, ocot a pod.) (obr. 6.16)
Stanovište č. 9 – 4 striekačky, 2 hadičky, 2 tlačky, stojan, oxid uhličitý (kúsky medeného plechu, kyselina dusičná), digestor, striekačka s bočným vývodom, zátka do skúmavky, hadička na vývod striekačky (obr. 6.17)
Postup práce:
Stanovište č. 7 Pozorovanie delenia vzduchu
1. Nasaj do striekačky s hadičkou vzduch.
2. Vlož hadičku do kadičky s vodou.
3. Pomaly a prerušovanie zatláčaj piest striekačky.
4. Zaznamenaj si do tabuľky svoje pozorovanie, vysvetlenie a číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 71. (Daj stanovište pred opustením do pôvodného stavu.)
Na stanovišti č. 6 je úlohou žiakov analyzovať správanie sa farebnej kvapaliny (najlepšie atramentu) vo vode. Žiaci kvapnú kvapkadlom (pipetou) kvapku atramentu do kadičky s vodou. Kvapalinu nechajú na pokojnom mieste a chvíľu pozorujú jej správanie. Po pozorovaní si zaznamenajú svoje postrehy do tabuľky. Daná aktivita potvrdzuje výrok č. 6 – Častice látky sa ustavične neusporiadane pohybujú.
Všetky tekutiny majú tendenciu prechádzať z prostredia s vyššou koncentráciou do prostredia s nižšou koncentráciou. Prirodzenou vlastnosťou tekutín je, že sa rozptyľujú do celého priestoru, a postupne vo všetkých jeho častiach vyrovnajú svoju koncentráciu. Hovoríme, že látky difundujú.
Pre urýchlenie pozorovania môžeme dať na stanovište 2 kadičky. V jednej budú žiaci pozorovať kvapnutie atramentu a druhá bude stabilne položená na stanovišti ako vzor difúzie častíc atramentu do celého priestoru po dlhšom čase.
Zhrňujúce otázky:
1. Otázka smeruje k záverečnému zovšeobecneniu. Pre všetky stanovištia platí výrok 1.
2. Zdôrazniť by sa mali rozdiely medzi tuhými látkami a kvapalinami, väzby medzi časticami. Dôsledkom iného druhu väzieb pri kvapalinách je opätovné spájanie kvapiek do jedného celku.
3. Potvrdenie výrokov 4, 5. Na rozklad chemickej väzby je potrebná energia (elektrická). Voda sa rozložila na kyslík a vodík.
4. Potvrdenie výroku 6.
Názov aktivity 3 – Pozorovanie plynov
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre plyny
Pomôcky:
Stanovište č. 7 – kadička, striekačka, hadička z plastu, voda (obr. 6.15)
Stanovište č. 8 – aromatická kvapalina uzavretá v nádobe (voňavka, zriedený čpavok, ocot a pod.) (obr. 6.16)
Stanovište č. 9 – 4 striekačky, 2 hadičky, 2 tlačky, stojan, oxid uhličitý (kúsky medeného plechu, kyselina dusičná), digestor, striekačka s bočným vývodom, zátka do skúmavky, hadička na vývod striekačky (obr. 6.17)
Postup práce:
Stanovište č. 7 Pozorovanie delenia vzduchu
1. Nasaj do striekačky s hadičkou vzduch.
2. Vlož hadičku do kadičky s vodou.
3. Pomaly a prerušovanie zatláčaj piest striekačky.
4. Zaznamenaj si do tabuľky svoje pozorovanie, vysvetlenie a číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 71. (Daj stanovište pred opustením do pôvodného stavu.)
 Stanovište č. 8 Pozorovanie aromatickej látky
1. Na stanovišti je uzavretá nádoba s aromatickou látkou. Otvor nádobu a daj ju približne 30 cm od nosa.
2. Zaznamenaj si do tabuľky svoje pozorovanie, vysvetlenie a čísla výrokov z atómovej teórie, ktoré podporujú pozorovanie na stanovišti č. 8.
Stanovište č. 8 Pozorovanie aromatickej látky
1. Na stanovišti je uzavretá nádoba s aromatickou látkou. Otvor nádobu a daj ju približne 30 cm od nosa.
2. Zaznamenaj si do tabuľky svoje pozorovanie, vysvetlenie a čísla výrokov z atómovej teórie, ktoré podporujú pozorovanie na stanovišti č. 8.
 Stanovište č. 9 Pozorovanie plynov v striekačkách
Na obrázku sú dvojice injekčných striekačiek. Striekačky sú naplnené plynmi už dlhší čas. Na začiatku pokusu bol tlačkou oddelený oxid dusičitý (hustejší plyn) od vzduchu (redšieho plynu). V druhej dvojici boli rovnaké plyny, ale umiestnene plynov je presne naopak ako v prvej dvojici. Deje v striekačkách prebiehali aspoň 24 hodín.
Stanovište č. 9 Pozorovanie plynov v striekačkách
Na obrázku sú dvojice injekčných striekačiek. Striekačky sú naplnené plynmi už dlhší čas. Na začiatku pokusu bol tlačkou oddelený oxid dusičitý (hustejší plyn) od vzduchu (redšieho plynu). V druhej dvojici boli rovnaké plyny, ale umiestnene plynov je presne naopak ako v prvej dvojici. Deje v striekačkách prebiehali aspoň 24 hodín.
 1. Dá sa po dlhšom čase rozlíšiť, v ktorej skúmavke bol priezračný vzduch a v ktorej hnedý oxid dusičitý?
2. Zaznamenaj si do tabuľky svoje pozorovanie, vysvetlenie a čísla výrokov z atómovej teórie, ktoré podporujú pozorovanie na stanovišti č. 9.
Zhrňujúce otázky:
1. Ktoré z overovaných výrokov sa potvrdili pri pozorovaní plynov na 8. a 9. stanovišti?
2. Čo sa udialo s bublinkami plynov vytlačených zo striekačky do vody?
3. Ako si vysvetľuješ skutočnosť, že kvapalnú aromatickú látku možno cítiť aj do vzdialenosti 30 cm od hladiny kvapaliny, prípadne aj do väčšej vzdialenosti?
4. Čo sa udialo s plynmi rôznej hustoty po dlhšej dobe? Ako je možné, že hustejší plyn nezostal len v spodnej striekačke?
5. Prezentuj svoje závery z pozorovaní pred triedou. Ktorá skupina vysvetlila svoje pozorovania najlepšie?
Zhrňujúce otázky k aktivitám 1-3:
1. Ktoré z overovaných výrokov sa potvrdili pri pozorovaní tuhých, kvapalných a plynných látkach? Ktorý výrok (výroky) mal(i) najväčšiu podporu na jednotlivých stanovištiach?
2. Ktoré z výrokov možno dokázať len špeciálnymi zariadeniami, prístrojmi?
3. Ktoré ďalšie experimenty by si vedel navrhnúť ako dôkaz výrokov atómovej teórie?
4. Ako by si charakterizoval a porovnal väzby medzi časticami v tuhých, kvapalných a plynných látkach?
5. Platí výrok č. 6 aj pre tuhé látky? Vysvetli svoju predstavu o pohybe častíc v tuhých, kvapalných a plynných látkach.
Učiteľská verzia k aktivite 3
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre plyny.
Vysvetlenie obsahu aktivity:
Aktivita s aromatickou látkou nepriamo dokazuje neustály pohyb častíc. Na stanovišti možno použiť aromatické látky napr. voňavku alebo ocot.
Na stanovišti žiaci otvoria nádobu s kvapalnou aromatickou látkou a dajú si ju približne 30 cm od tváre. Chvíľu nádobu podržia v uvedenej vzdialenosti a zaznamenajú si do tabuľky svoje pozorovania, vysvetlenia a výroky.
Daná aktivita je prejavom difúzie plynov. Všetky látky majú tendenciu prechádzať z prostredia s jej vyššou koncentráciou do prostredia s jej nižšou koncentráciou. Prirodzenou vlastnosťou látok je, že sa jej častice rozptyľujú do celého priestoru. Ide aj o dôsledok neustáleho, neusporiadaného pohybu častíc. Hovoríme, že látky difundujú.
Zostavenie pokusu a aparatúry na stanovišti č. 9 – Pozorovanie plynov v striekačkách, by mal vyučujúci pripraviť bez prítomnosti žiakov a v digestóriu. Ide o vyrobenie plynu oxidu dusičitého, ktorý je výhodný pre svoju výrazne hnedú farbu. Potrebujeme na výrobu malé kúsky medeného plechu, ktorý v skúmavke zalejeme kyselinou dusičnou. Pri reakcii vzniká hnedý plyn. Najlepšie je použiť skúmavku s bočným otvorom. Skúmavku pri vzniku plynu zazátkujeme a necháme otvorený bočný otvor pre únik vzduchu. Po naplnení celej skúmavky plynom môžeme z bočného otvoru nasať plyn do dvoch striekačiek na ktorých je hadička s tlačkou. Prípadne možno použiť aj iný, menej škodlivý plyn, podmienkou je, aby bol farebný.
Striekačky upevníme na stojan tak, ako je to uvedené na obr. 6.17 v žiackej verzii. V jednej sústave striekačiek bol tlačkou oddelený oxid dusičitý od vzduchu. V druhej dvojici boli rovnaké plyny ale umiestnené presne naopak. Deje v striekačkách môžu prebiehať do ďalšej hodiny, kde sú súčasťou stanovišťa č. 9.
Difúzia prebieha vo všetkých skupenstvách. Najrýchlejšie prebieha v plynoch, pretože v plynoch sa molekuly najrýchlejšie pohybujú. Pomocou neustáleho pohybu častíc sa plyny časom usporiadali tak, že hustejší a redší plyn sa premiešajú.
Zhrňujúce otázky:
1. Predovšetkým výrok 2.
2. Bublinky stúpali k hladne vody. Vysvetlenie môžeme akceptovať cez hustotu, alebo hydrostatickú vztlakovú silu (pokiaľ sa so žiakmi preberala v 8. ročníku hydrostatická vztlaková sila).
3. Vyparovaním molekúl a neustálym, neusporiadaným pohybom častíc (výrok č. 6).
4. Platí výrok č. 6. V diskusii by sa mohla položiť otázka gravitačného pôsobenia na častice plynu a neusporiadaný pohyb častíc a ich vzájomné nárazy.
Zhrňujúce otázky k aktivitám 1-3:
1. Ide predovšetkým i výroky č. 1 a 2.
2. Výrok 3 (kryštály) a výrok 5 (elektrolýza vody).
3. Tu je potrebné nechať žiakov voľne navrhovať pokusy z fyziky či chémie.
4. Charakteristika látok sa môže opierať o F7 s. 63.
5. Odpoveď sa môže opierať o obsah v učebnici fyziky pre 7. ročník (Lapitková, 2010b, s. 63).
Tabuľka 6.3 Výsledok pozorovania žiakov
1. Dá sa po dlhšom čase rozlíšiť, v ktorej skúmavke bol priezračný vzduch a v ktorej hnedý oxid dusičitý?
2. Zaznamenaj si do tabuľky svoje pozorovanie, vysvetlenie a čísla výrokov z atómovej teórie, ktoré podporujú pozorovanie na stanovišti č. 9.
Zhrňujúce otázky:
1. Ktoré z overovaných výrokov sa potvrdili pri pozorovaní plynov na 8. a 9. stanovišti?
2. Čo sa udialo s bublinkami plynov vytlačených zo striekačky do vody?
3. Ako si vysvetľuješ skutočnosť, že kvapalnú aromatickú látku možno cítiť aj do vzdialenosti 30 cm od hladiny kvapaliny, prípadne aj do väčšej vzdialenosti?
4. Čo sa udialo s plynmi rôznej hustoty po dlhšej dobe? Ako je možné, že hustejší plyn nezostal len v spodnej striekačke?
5. Prezentuj svoje závery z pozorovaní pred triedou. Ktorá skupina vysvetlila svoje pozorovania najlepšie?
Zhrňujúce otázky k aktivitám 1-3:
1. Ktoré z overovaných výrokov sa potvrdili pri pozorovaní tuhých, kvapalných a plynných látkach? Ktorý výrok (výroky) mal(i) najväčšiu podporu na jednotlivých stanovištiach?
2. Ktoré z výrokov možno dokázať len špeciálnymi zariadeniami, prístrojmi?
3. Ktoré ďalšie experimenty by si vedel navrhnúť ako dôkaz výrokov atómovej teórie?
4. Ako by si charakterizoval a porovnal väzby medzi časticami v tuhých, kvapalných a plynných látkach?
5. Platí výrok č. 6 aj pre tuhé látky? Vysvetli svoju predstavu o pohybe častíc v tuhých, kvapalných a plynných látkach.
Učiteľská verzia k aktivite 3
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre plyny.
Vysvetlenie obsahu aktivity:
Aktivita s aromatickou látkou nepriamo dokazuje neustály pohyb častíc. Na stanovišti možno použiť aromatické látky napr. voňavku alebo ocot.
Na stanovišti žiaci otvoria nádobu s kvapalnou aromatickou látkou a dajú si ju približne 30 cm od tváre. Chvíľu nádobu podržia v uvedenej vzdialenosti a zaznamenajú si do tabuľky svoje pozorovania, vysvetlenia a výroky.
Daná aktivita je prejavom difúzie plynov. Všetky látky majú tendenciu prechádzať z prostredia s jej vyššou koncentráciou do prostredia s jej nižšou koncentráciou. Prirodzenou vlastnosťou látok je, že sa jej častice rozptyľujú do celého priestoru. Ide aj o dôsledok neustáleho, neusporiadaného pohybu častíc. Hovoríme, že látky difundujú.
Zostavenie pokusu a aparatúry na stanovišti č. 9 – Pozorovanie plynov v striekačkách, by mal vyučujúci pripraviť bez prítomnosti žiakov a v digestóriu. Ide o vyrobenie plynu oxidu dusičitého, ktorý je výhodný pre svoju výrazne hnedú farbu. Potrebujeme na výrobu malé kúsky medeného plechu, ktorý v skúmavke zalejeme kyselinou dusičnou. Pri reakcii vzniká hnedý plyn. Najlepšie je použiť skúmavku s bočným otvorom. Skúmavku pri vzniku plynu zazátkujeme a necháme otvorený bočný otvor pre únik vzduchu. Po naplnení celej skúmavky plynom môžeme z bočného otvoru nasať plyn do dvoch striekačiek na ktorých je hadička s tlačkou. Prípadne možno použiť aj iný, menej škodlivý plyn, podmienkou je, aby bol farebný.
Striekačky upevníme na stojan tak, ako je to uvedené na obr. 6.17 v žiackej verzii. V jednej sústave striekačiek bol tlačkou oddelený oxid dusičitý od vzduchu. V druhej dvojici boli rovnaké plyny ale umiestnené presne naopak. Deje v striekačkách môžu prebiehať do ďalšej hodiny, kde sú súčasťou stanovišťa č. 9.
Difúzia prebieha vo všetkých skupenstvách. Najrýchlejšie prebieha v plynoch, pretože v plynoch sa molekuly najrýchlejšie pohybujú. Pomocou neustáleho pohybu častíc sa plyny časom usporiadali tak, že hustejší a redší plyn sa premiešajú.
Zhrňujúce otázky:
1. Predovšetkým výrok 2.
2. Bublinky stúpali k hladne vody. Vysvetlenie môžeme akceptovať cez hustotu, alebo hydrostatickú vztlakovú silu (pokiaľ sa so žiakmi preberala v 8. ročníku hydrostatická vztlaková sila).
3. Vyparovaním molekúl a neustálym, neusporiadaným pohybom častíc (výrok č. 6).
4. Platí výrok č. 6. V diskusii by sa mohla položiť otázka gravitačného pôsobenia na častice plynu a neusporiadaný pohyb častíc a ich vzájomné nárazy.
Zhrňujúce otázky k aktivitám 1-3:
1. Ide predovšetkým i výroky č. 1 a 2.
2. Výrok 3 (kryštály) a výrok 5 (elektrolýza vody).
3. Tu je potrebné nechať žiakov voľne navrhovať pokusy z fyziky či chémie.
4. Charakteristika látok sa môže opierať o F7 s. 63.
5. Odpoveď sa môže opierať o obsah v učebnici fyziky pre 7. ročník (Lapitková, 2010b, s. 63).
Tabuľka 6.3 Výsledok pozorovania žiakov
 Prvou úlohou žiaka je zohrievať banku rukami a pozorovať pohyb, klesanie kvapalinového stĺpca, ktorý bol vytvorený následkom podtlaku v banke a v rúrke. Podtlak sme dosiahli miernym vytiahnutím piesta v striekačke. Následným ochladením banky studenou vodou sa kvapalinový stĺpec začne pohybovať smerom hore.
Úlohou žiakov je opísať pozorovanie a vysvetliť priebeh pokusu. Najčastejšie sa vo vysvetleniach žiakov objavuje rozťažnosť plynu, zväčšenie jeho objemu ako dôsledok odovzdávania tepla, a pri ochladzovaním nádoby zmenšenie objemu plynu.
Na konci tejto témy však prejdeme k hlbšiemu vysvetleniu, smerujeme k príčine zmeny objemu vzduchu v banke, a to k zmene pohybovej energie častíc plynu ako dôsledku odovzdaného tepla.
V druhom kroku by sa mali žiaci oboznámiť s chápaním tepla v minulosti – s teóriou kalorika a pokusmi Rumforda a Davyho. Z hľadiska ďalšieho poznávania je dôležité zdôraznenie výroku oboch bádateľov – teplo je druh pohybu. Práve téma teplo dáva vo vyučovaní priestor na zohľadnenie vývoja vedeckého poznania, zmien vo vysvetľovaní javov, a tým aj celých teórií.
V ďalšom, treťom kroku, je dôležité uvažovať so žiakmi o ich skúsenosti – aké zmeny môže vyvolať zohrievanie či ochladzovanie plynných, kvapalných a tuhých telies. Tento krok pomáha prepojiť praktickú skúsenosť žiaka s odbornými pomenovaniami a vysvetleniami.
O tom, že sa teplo môže šíriť vedením, prúdením a žiarením, by sa žiaci mali presvedčiť jednoduchými experimentmi, ktorých súčasťou je aj zostrojenie kalorimetra z jednoduchých pomôcok (obrázok 6.5). Zostrojenie kalorimetra je veľmi dôležitý krok pri ďalšom experimentovaní. Vďaka jeho izolačným vlastnostiam prebieha v ňom výmena bez väčších strát.
Prvou úlohou žiaka je zohrievať banku rukami a pozorovať pohyb, klesanie kvapalinového stĺpca, ktorý bol vytvorený následkom podtlaku v banke a v rúrke. Podtlak sme dosiahli miernym vytiahnutím piesta v striekačke. Následným ochladením banky studenou vodou sa kvapalinový stĺpec začne pohybovať smerom hore.
Úlohou žiakov je opísať pozorovanie a vysvetliť priebeh pokusu. Najčastejšie sa vo vysvetleniach žiakov objavuje rozťažnosť plynu, zväčšenie jeho objemu ako dôsledok odovzdávania tepla, a pri ochladzovaním nádoby zmenšenie objemu plynu.
Na konci tejto témy však prejdeme k hlbšiemu vysvetleniu, smerujeme k príčine zmeny objemu vzduchu v banke, a to k zmene pohybovej energie častíc plynu ako dôsledku odovzdaného tepla.
V druhom kroku by sa mali žiaci oboznámiť s chápaním tepla v minulosti – s teóriou kalorika a pokusmi Rumforda a Davyho. Z hľadiska ďalšieho poznávania je dôležité zdôraznenie výroku oboch bádateľov – teplo je druh pohybu. Práve téma teplo dáva vo vyučovaní priestor na zohľadnenie vývoja vedeckého poznania, zmien vo vysvetľovaní javov, a tým aj celých teórií.
V ďalšom, treťom kroku, je dôležité uvažovať so žiakmi o ich skúsenosti – aké zmeny môže vyvolať zohrievanie či ochladzovanie plynných, kvapalných a tuhých telies. Tento krok pomáha prepojiť praktickú skúsenosť žiaka s odbornými pomenovaniami a vysvetleniami.
O tom, že sa teplo môže šíriť vedením, prúdením a žiarením, by sa žiaci mali presvedčiť jednoduchými experimentmi, ktorých súčasťou je aj zostrojenie kalorimetra z jednoduchých pomôcok (obrázok 6.5). Zostrojenie kalorimetra je veľmi dôležitý krok pri ďalšom experimentovaní. Vďaka jeho izolačným vlastnostiam prebieha v ňom výmena bez väčších strát.
 Aby sme žiaka postupne pripravovali na vzťah pre výpočet tepla, mal by mať skúsenosť s výmenou tepla medzi horúcou a studenou vodou, s pokusom, ktorý robil aj Fahrenheit. Keď zlievame rovnaké objemy horúcej a studenej vody, zjednodušíme kalorimetrickú rovnicu o hmotnosti telies a hmotnostné tepelné kapacity látok. Pri použití kalorimetra zhotoveného z jednoduchých pomôcok neberieme do úvahy teplo odovzdané kalorimetru. Pokusom sústredíme pozornosť žiaka na počiatočné teploty zlievaných objemov vody a na výslednú teplotu.
Žiaci niekoľkokrát opakujú pokus a predpovedajú hodnoty výslednej teploty, potom merajú výslednú teplotu a hodnoty zapisujú do tabuľky (Lapitková, 2010b, s. 71). Ich predpovede sú pri opakovaných meraniach obyčajne presnejšie, bližšie k reálnym hodnotám, až kým prídu na to, že výsledná teplota sa dá vypočítať tak, že sa sčítajú počiatočné teploty a vydelia dvoma. Následne môžu žiaci meniť aj objemy kvapalín a skúmať túto zmenu vo vzťahu k výslednej teplote.
Zavedeniu vzťahu pre výpočet tepla predchádza skúsenosť s výmenou tepla medzi kovmi a vodou. Žiaci merajú hmotnosti kovov a vody, pre zjednodušenie mala by výmena tepla prebehnúť medzi vodou s rovnakou hmotnosťou ako má kov. Zohrievame kov (v horúcej vode), ktorý po vložení do kalorimetra s vodou izbovej teploty, odovzdáva teplo. Dôležité v tomto postupe je zaviesť pre rozdiel teplôt znak Δt.
V triede sa predpokladá skupinová práca žiakov, pretože hodnoty namerané v každej skupine sa v závere merania zozbierajú a vytvoria podklad pre zostrojenie grafov (obr. 6.6).
Aby sme žiaka postupne pripravovali na vzťah pre výpočet tepla, mal by mať skúsenosť s výmenou tepla medzi horúcou a studenou vodou, s pokusom, ktorý robil aj Fahrenheit. Keď zlievame rovnaké objemy horúcej a studenej vody, zjednodušíme kalorimetrickú rovnicu o hmotnosti telies a hmotnostné tepelné kapacity látok. Pri použití kalorimetra zhotoveného z jednoduchých pomôcok neberieme do úvahy teplo odovzdané kalorimetru. Pokusom sústredíme pozornosť žiaka na počiatočné teploty zlievaných objemov vody a na výslednú teplotu.
Žiaci niekoľkokrát opakujú pokus a predpovedajú hodnoty výslednej teploty, potom merajú výslednú teplotu a hodnoty zapisujú do tabuľky (Lapitková, 2010b, s. 71). Ich predpovede sú pri opakovaných meraniach obyčajne presnejšie, bližšie k reálnym hodnotám, až kým prídu na to, že výsledná teplota sa dá vypočítať tak, že sa sčítajú počiatočné teploty a vydelia dvoma. Následne môžu žiaci meniť aj objemy kvapalín a skúmať túto zmenu vo vzťahu k výslednej teplote.
Zavedeniu vzťahu pre výpočet tepla predchádza skúsenosť s výmenou tepla medzi kovmi a vodou. Žiaci merajú hmotnosti kovov a vody, pre zjednodušenie mala by výmena tepla prebehnúť medzi vodou s rovnakou hmotnosťou ako má kov. Zohrievame kov (v horúcej vode), ktorý po vložení do kalorimetra s vodou izbovej teploty, odovzdáva teplo. Dôležité v tomto postupe je zaviesť pre rozdiel teplôt znak Δt.
V triede sa predpokladá skupinová práca žiakov, pretože hodnoty namerané v každej skupine sa v závere merania zozbierajú a vytvoria podklad pre zostrojenie grafov (obr. 6.6).
 Pokiaľ by sme postupovali historickou cestou a do zavedenia mechanického ekvivalentu tepla ponechali ako jednotku tepla kalóriu, c vody bude mať hodnotu 1 cal/g·°C, môžeme hmotnostnú tepelnú kapacitu skúmaných kovov vypočítať ako podiel Δtv/Δtk .
Z hodnôt Δtv, Δtk vieme vyčítať, že kým pri výmene tepla kovy dosiahli rozdiel teplôt o desiatky stupňov Celzia, zatiaľ voda zmenila svoju teplotu len o niekoľko stupňov (viď. Tabuľku 6.1).
Tabuľka 6.1 Výmena tepla medzi kovmi a vodou
Pokiaľ by sme postupovali historickou cestou a do zavedenia mechanického ekvivalentu tepla ponechali ako jednotku tepla kalóriu, c vody bude mať hodnotu 1 cal/g·°C, môžeme hmotnostnú tepelnú kapacitu skúmaných kovov vypočítať ako podiel Δtv/Δtk .
Z hodnôt Δtv, Δtk vieme vyčítať, že kým pri výmene tepla kovy dosiahli rozdiel teplôt o desiatky stupňov Celzia, zatiaľ voda zmenila svoju teplotu len o niekoľko stupňov (viď. Tabuľku 6.1).
Tabuľka 6.1 Výmena tepla medzi kovmi a vodou
 Po uvedených skúsenostiach žiakov s pozorovaním, meraním, experimentovaním a predpovedaním výsledných teplôt sa zavedie vzťah pre výpočet tepla.
V ďalšom kroku sa žiaci opäť vrátia k hodnotám nameraným pri odovzdávaní tepla medzi kovmi a vodou a počítajú teplo odovzdané kovom a teplo prijaté vodou. Graf zostrojený z vypočítaných hodnôt odovzdaného tepla kovom a tepla prijatého vodou vykazuje lineárnu závislosť.
Prechod jednotky tepla z kalórie na joule opäť prebieha cez meranie. Modelom Joulovho pokusu je zariadenie pozostávajúce z plastovej trubice s dĺžkou 1 m (obrázok 6.7), v ktorej sa presýpajú oceľové broky (napr. 300 g).
Po uvedených skúsenostiach žiakov s pozorovaním, meraním, experimentovaním a predpovedaním výsledných teplôt sa zavedie vzťah pre výpočet tepla.
V ďalšom kroku sa žiaci opäť vrátia k hodnotám nameraným pri odovzdávaní tepla medzi kovmi a vodou a počítajú teplo odovzdané kovom a teplo prijaté vodou. Graf zostrojený z vypočítaných hodnôt odovzdaného tepla kovom a tepla prijatého vodou vykazuje lineárnu závislosť.
Prechod jednotky tepla z kalórie na joule opäť prebieha cez meranie. Modelom Joulovho pokusu je zariadenie pozostávajúce z plastovej trubice s dĺžkou 1 m (obrázok 6.7), v ktorej sa presýpajú oceľové broky (napr. 300 g).
 Práca sa koná v gravitačnom poli Zeme, broky padajú kolmo k zemi. Potrebujeme zmerať počiatočnú teplotu brokov, dĺžku trubice a po niekoľkonásobnom počte otočení trubice (30, 60, 90) aj výslednú teplotu brokov. Vypočíta sa vykonaná práca (J) a vyprodukované teplo (cal). Výpočtom alebo pomocou grafu, možno zistiť prácu potrebnú na vyprodukovanie tepla 1 cal. S veľkou pravdepodobnosťou sa nepodarí v školských podmienkach určiť presne vzťah 1 cal = 4,18 J, podarí sa však ukázať cestu, ako sa k hodnote 4,18 dospelo.
Dôležité je žiakom ukázať aj praktickú využiteľnosť určenia hodnoty prijatého či odovzdaného tepla, a to na príklade zisťovania energie potravín, čo možno pokusne ukázať v pokuse so spaľovaním orieška, ktorý odovzdáva teplo vode.
Na záver by sa mali žiaci opäť vrátiť k modelu Galileovho termoskopu. Očakávame, že ich vysvetlenia prebiehajúceho deja pri zohrievaní a ochladzovaní banky so vzduchom by mali byť oveľa odbornejšie a smerujúce až k časticovej stavbe látok. Dokonca by mali navrhnúť spôsob zmerania hodnôt, prípadne úpravu zariadenia tak, aby bolo možné určiť prijaté teplo. Záverečná diskusia je aj testom učiteľovej práce.
Postup od konkrétnych, jedinečných výrokov k všeobecným súdom je postupom induktívnym. Zoradením aktivít, v ktorých žiaci uvažujú, pozorujú, vysvetľujú, merajú, spracúvajú namerané údaje a vyvodzujú závery, rozvíja u nich spôsobilosti vedeckej práce. Uvedené spôsobilosti sú v progresívnych obsahoch vyučovania fyziky ich integrálnou súčasťou, a preto keď sa zamýšľame nad tvorbou obsahu vyučovania, musíme mať na mysli aj ciele fyzikálneho vzdelávania, teda to, čo chceme prostredníctvom obsahu dosiahnuť.
Náročné fyzikálne pojmy nemožno zavádzať oznámením „vzorca“ a vyriešením niekoľkých príkladov na jeho využitie, ale prostredníctvom aktivít, v ktorých žiaci hľadajú a objavujú vzťahy a získavajú s daným pojmom skúsenosti. Rozčlenenie obsahu do jednotlivých krokov a vytvorenie aktivít pre žiakov tak, aby zodpovedali pravidlám induktívneho postupu, je úlohou didaktikov fyziky.
6.4.2 Deduktívny spôsob v téme o časticovej stavbe látok
Novým prístupom v súčasnom Štátnom vzdelávacom programe fyziky je aj vysvetľovanie javov na základe časticovej stavby látok. Zatiaľ čo v predchádzajúcej koncepcii už v 6. ročníku sa žiak učil o zložení atómu a vysvetľovaní javov na základe časticovej stavby látok, v súčasnej koncepcii sa k takémuto vysvetleniu dostáva neskôr. Dôraz je na postupnom prenikaní do podstaty javov cez pozorovanie vonkajších znakov, napr. zovšeobecnenie poznatku – deliteľnosť je všeobecná vlastnosť tuhých, kvapalných a plynných telies – žiak získa priamou skúsenosťou. Až po zavedení pojmu teplo a následným vysvetľovaním zmien štruktúry látky pri premenách skupenstva, učebnica prináša vysvetlenie založené na časticovej stavbe látok. Tomuto vysvetleniu však predchádza skúsenosť s meraním teploty v priebehu času pri premenách skupenstva kryštalických látok a následným spracovaním meraní do grafu. Pozorovanie reálneho priebehu premeny skupenstva a priebeh čiary grafu by malo žiakov upozorniť, že dodávané (odoberané) teplo spôsobuje premenu vnútornej štruktúry látky.
Vo fyzike vystačíme po 9. ročník s pojmami častica, atóm, molekula. Chémia zavádza stavbu atómu v 8. ročníku, a tak pri vysvetlení vzniku elektrického náboja, či definícii elektrického prúdu už možno pracovať s termínmi, ako je ión či elektrón, prípadne vysvetlením elektrickej vodivosti látok.
Aktivity 1 - 3 je potrebné brať ako celok, pretože sa viažu na spoločnú „teóriu“ o časticovej stavbe látok. Niektoré skúsenosti s delením látok, či experimentmi zaradenými do aktivít k téme 3 už žiaci zo základného obsahu vyučovania majú. Preto je možné sústrediť sa na overovanie vybraných výrokov teórie o časticovej stavbe látok a rozvoj deduktívneho myslenia žiakov. Žiakom možno pri predložených aktivitách ukázať ako pracujú vedci, ako sa tvorí a overuje vedecká teória. Treba však zdôrazniť, že ide o vybrané výroky teórie o časticovej stavbe látok, prispôsobenej teórie pre žiacke overovanie.
Cieľom aktivít je, aby žiak porozumel pojmu vedecká teória, pochopil proces overovania výrokov vedeckej teórie a rozvíjalo sa u neho deduktívne myslenie a procesy zovšeobecnenia pri dôkazoch časticovej stavby látok. V neposlednom rade by žiak mal byť schopný rozlíšiť pozorovanie od vysvetlenia a vedieť opísať svoju predstavu časticovej stavby tuhých látok. Okrem kognitívnych cieľov ide aj o napĺňanie afektívnych cieľov ako sú vyhľadávať a zaznamenávať si informácie, viesť diskusie a spolupracovať v tíme, porozumieť vplyvu technického pokroku na vedecké skúmania, kriticky vyhodnotiť kvalitu záverov z pozorovaní a ich vysvetlení jednotlivými. K psychomotorickým cieľom aktivít patrí vykonať pozorovania a vypracovať záznam o pozorovaní.
Skúsenosti s delením kvapalín by žiaci mali mať už zo 6. ročníka. Pri stanovišti 4 aktivity 2 by si však mali tiež všimnúť rozdiel medzi delením tuhých látok a kvapalín, ktoré možno ľahko opäť spojiť do jedného celku. Ide o upozornenie na inú kvalitu väzbových síl medzi časticami.
Elektrolýza vody je podrobne rozpísaná v učebnici fyziky pre 9. ročník (Lapitková, 2012, s. 87-88). Bolo by však dobré stanovište urobiť a na konci elektrolýzy dokázať plameňom prítomnosť kyslíka a vodíka. Na zápornom póle batérie sa vylučuje vodík, ktorý dokážeme tak, že odtlačkujeme hadičku na valci striekačky a priložíme zápalku. Plyn by mal šteknúť. Potom valce striekačiek nadvihneme a priložíme k valcu, ktorý bol položený na kladnom póle batérie, tlejúcu zápalku. Mala by sa rozhorieť.
Difúzia je jav málo zdôraznený v základnom obsahu fyziky pre 7. ročník (Lapitková, 2010b, s. 64). Preto je dôležité zaoberať sa týmto javom a v diskusii je možné spomenúť aj spôsob jeho objavenia Brownom.
Deliteľnosť, ako všeobecná vlastnosť tuhých, kvapalných a plynných látok, je obsahom fyziky už v 6. ročníku ZŠ. Na 7. stanovišti aktivity 3 sa opakuje delenie vzduchu, ktoré je uvedené aj v učebnici fyziky pre 6. ročník (Lapitková, 2010a, s. 27). Z dôvodu dodržania systematickosti je dôležité, aby sa realizoval aj pri tejto aktivite.
Difúzii, Brownovmu pohybu častíc, ako aj časticovému zloženiu látok vôbec, sa v obsahu fyziky na ZŠ nevenuje toľko priestoru ako v predchádzajúcej koncepcii. Preto práve pokusy s aromatickou látkou a difúziou plynov rozširujú vedomosti žiakov.
Žiacka verzia – Dôkazy časticovej stavby látok
Myšlienka o existencii atómov je veľmi stará. O atómoch už hovorili starovekí Gréci okolo r. 400 pred n. l. Atómová teória, súbor tvrdení, že látky sa skladajú z malých častíc, nazývaných atómy, je dnes už všeobecne prijatá. Pri riešení aktivít sa nebudeme pýtať či atómy jestvujú, budeme však pátrať po ich existencii a usilovať sa lepšie porozumieť časticovému zloženiu látky. Zároveň budeme napodobňovať prácu vedcov pri dokazovaní vybraných výrokov z atómovej teórie.
Teória je súbor tvrdení o predmete výskumu, ktoré v danej etape poznania považujeme za pravdivé. Vyžaduje sa, aby nebola v rozpore so súčasnými skúsenosťami a výsledkami experimentov. Teória je zovšeobecnením skúseností z praxe. Teória často predpovedá vlastnosti a javy, ktoré v čase formulovania teórie ešte neboli prakticky pozorované. Ak sa takéto predpovede potvrdia, je to silný dôkaz o pravdivosti teórie, ak sa nepotvrdia, tak je daná teória neplatná a musí sa preformulovať, alebo musí vzniknúť úplne nová teória.
Pre to, aby bola teória považovaná za vedeckú, musí spĺňať viacero kritérií. Napr. medzi kritéria vedeckej teórie patrí, že skúmaný jav má byť:
- vysvetľovaný čo najjednoduchším spôsobom,
- založený na kontrolovateľných a opakovateľných experimentoch alebo pozorovaniach.
Zostavili sme súbor vybraných výrokov do tzv. „atómovej teórie“, ktoré sa dajú overiť aj v školskom laboratóriu. Časticová stavba látok je predmetom skúmania chémie a fyziky. Vysvetľovanie niektorých javov napr. premeny skupenstva, elektrické javy či chemické vlastnosti látok spočívajú v časticovej stavbe látok.
Budeš sa zamýšľať nad úlohami zadávanými na jednotlivých stanovištiach. Na stanovištiach sú potrebné pomôcky. Podľa návodu vykonaj činnosti, zaznamenaj pozorovania a vysvetlenia. Závery, ktoré si poznačíš do tabuľky 6.2, sa budú týkať aj výrokov, ktoré sú vybrané pre školské skúmanie a majú byť výsledkom diskusie v skupine.
Vybrané výroky atómovej teórie:
1. Telesá z rozličných látok možno rozdeliť na menšie časti.
2. Každá látka je zložená z malých neviditeľných častíc nazývaných atómy.
3. Atómy toho istého prvku majú rovnaké vlastnosti.
4. Atómy rôznych prvkov majú rôzne vlastnosti.
5. Atómy tvoria zlúčeniny v pomere celých čísel.
6. Častice látky sa ustavične neusporiadane pohybujú.
Tabuľka 6.2 Overovanie vybraných výrokov atómovej teórie
Práca sa koná v gravitačnom poli Zeme, broky padajú kolmo k zemi. Potrebujeme zmerať počiatočnú teplotu brokov, dĺžku trubice a po niekoľkonásobnom počte otočení trubice (30, 60, 90) aj výslednú teplotu brokov. Vypočíta sa vykonaná práca (J) a vyprodukované teplo (cal). Výpočtom alebo pomocou grafu, možno zistiť prácu potrebnú na vyprodukovanie tepla 1 cal. S veľkou pravdepodobnosťou sa nepodarí v školských podmienkach určiť presne vzťah 1 cal = 4,18 J, podarí sa však ukázať cestu, ako sa k hodnote 4,18 dospelo.
Dôležité je žiakom ukázať aj praktickú využiteľnosť určenia hodnoty prijatého či odovzdaného tepla, a to na príklade zisťovania energie potravín, čo možno pokusne ukázať v pokuse so spaľovaním orieška, ktorý odovzdáva teplo vode.
Na záver by sa mali žiaci opäť vrátiť k modelu Galileovho termoskopu. Očakávame, že ich vysvetlenia prebiehajúceho deja pri zohrievaní a ochladzovaní banky so vzduchom by mali byť oveľa odbornejšie a smerujúce až k časticovej stavbe látok. Dokonca by mali navrhnúť spôsob zmerania hodnôt, prípadne úpravu zariadenia tak, aby bolo možné určiť prijaté teplo. Záverečná diskusia je aj testom učiteľovej práce.
Postup od konkrétnych, jedinečných výrokov k všeobecným súdom je postupom induktívnym. Zoradením aktivít, v ktorých žiaci uvažujú, pozorujú, vysvetľujú, merajú, spracúvajú namerané údaje a vyvodzujú závery, rozvíja u nich spôsobilosti vedeckej práce. Uvedené spôsobilosti sú v progresívnych obsahoch vyučovania fyziky ich integrálnou súčasťou, a preto keď sa zamýšľame nad tvorbou obsahu vyučovania, musíme mať na mysli aj ciele fyzikálneho vzdelávania, teda to, čo chceme prostredníctvom obsahu dosiahnuť.
Náročné fyzikálne pojmy nemožno zavádzať oznámením „vzorca“ a vyriešením niekoľkých príkladov na jeho využitie, ale prostredníctvom aktivít, v ktorých žiaci hľadajú a objavujú vzťahy a získavajú s daným pojmom skúsenosti. Rozčlenenie obsahu do jednotlivých krokov a vytvorenie aktivít pre žiakov tak, aby zodpovedali pravidlám induktívneho postupu, je úlohou didaktikov fyziky.
6.4.2 Deduktívny spôsob v téme o časticovej stavbe látok
Novým prístupom v súčasnom Štátnom vzdelávacom programe fyziky je aj vysvetľovanie javov na základe časticovej stavby látok. Zatiaľ čo v predchádzajúcej koncepcii už v 6. ročníku sa žiak učil o zložení atómu a vysvetľovaní javov na základe časticovej stavby látok, v súčasnej koncepcii sa k takémuto vysvetleniu dostáva neskôr. Dôraz je na postupnom prenikaní do podstaty javov cez pozorovanie vonkajších znakov, napr. zovšeobecnenie poznatku – deliteľnosť je všeobecná vlastnosť tuhých, kvapalných a plynných telies – žiak získa priamou skúsenosťou. Až po zavedení pojmu teplo a následným vysvetľovaním zmien štruktúry látky pri premenách skupenstva, učebnica prináša vysvetlenie založené na časticovej stavbe látok. Tomuto vysvetleniu však predchádza skúsenosť s meraním teploty v priebehu času pri premenách skupenstva kryštalických látok a následným spracovaním meraní do grafu. Pozorovanie reálneho priebehu premeny skupenstva a priebeh čiary grafu by malo žiakov upozorniť, že dodávané (odoberané) teplo spôsobuje premenu vnútornej štruktúry látky.
Vo fyzike vystačíme po 9. ročník s pojmami častica, atóm, molekula. Chémia zavádza stavbu atómu v 8. ročníku, a tak pri vysvetlení vzniku elektrického náboja, či definícii elektrického prúdu už možno pracovať s termínmi, ako je ión či elektrón, prípadne vysvetlením elektrickej vodivosti látok.
Aktivity 1 - 3 je potrebné brať ako celok, pretože sa viažu na spoločnú „teóriu“ o časticovej stavbe látok. Niektoré skúsenosti s delením látok, či experimentmi zaradenými do aktivít k téme 3 už žiaci zo základného obsahu vyučovania majú. Preto je možné sústrediť sa na overovanie vybraných výrokov teórie o časticovej stavbe látok a rozvoj deduktívneho myslenia žiakov. Žiakom možno pri predložených aktivitách ukázať ako pracujú vedci, ako sa tvorí a overuje vedecká teória. Treba však zdôrazniť, že ide o vybrané výroky teórie o časticovej stavbe látok, prispôsobenej teórie pre žiacke overovanie.
Cieľom aktivít je, aby žiak porozumel pojmu vedecká teória, pochopil proces overovania výrokov vedeckej teórie a rozvíjalo sa u neho deduktívne myslenie a procesy zovšeobecnenia pri dôkazoch časticovej stavby látok. V neposlednom rade by žiak mal byť schopný rozlíšiť pozorovanie od vysvetlenia a vedieť opísať svoju predstavu časticovej stavby tuhých látok. Okrem kognitívnych cieľov ide aj o napĺňanie afektívnych cieľov ako sú vyhľadávať a zaznamenávať si informácie, viesť diskusie a spolupracovať v tíme, porozumieť vplyvu technického pokroku na vedecké skúmania, kriticky vyhodnotiť kvalitu záverov z pozorovaní a ich vysvetlení jednotlivými. K psychomotorickým cieľom aktivít patrí vykonať pozorovania a vypracovať záznam o pozorovaní.
Skúsenosti s delením kvapalín by žiaci mali mať už zo 6. ročníka. Pri stanovišti 4 aktivity 2 by si však mali tiež všimnúť rozdiel medzi delením tuhých látok a kvapalín, ktoré možno ľahko opäť spojiť do jedného celku. Ide o upozornenie na inú kvalitu väzbových síl medzi časticami.
Elektrolýza vody je podrobne rozpísaná v učebnici fyziky pre 9. ročník (Lapitková, 2012, s. 87-88). Bolo by však dobré stanovište urobiť a na konci elektrolýzy dokázať plameňom prítomnosť kyslíka a vodíka. Na zápornom póle batérie sa vylučuje vodík, ktorý dokážeme tak, že odtlačkujeme hadičku na valci striekačky a priložíme zápalku. Plyn by mal šteknúť. Potom valce striekačiek nadvihneme a priložíme k valcu, ktorý bol položený na kladnom póle batérie, tlejúcu zápalku. Mala by sa rozhorieť.
Difúzia je jav málo zdôraznený v základnom obsahu fyziky pre 7. ročník (Lapitková, 2010b, s. 64). Preto je dôležité zaoberať sa týmto javom a v diskusii je možné spomenúť aj spôsob jeho objavenia Brownom.
Deliteľnosť, ako všeobecná vlastnosť tuhých, kvapalných a plynných látok, je obsahom fyziky už v 6. ročníku ZŠ. Na 7. stanovišti aktivity 3 sa opakuje delenie vzduchu, ktoré je uvedené aj v učebnici fyziky pre 6. ročník (Lapitková, 2010a, s. 27). Z dôvodu dodržania systematickosti je dôležité, aby sa realizoval aj pri tejto aktivite.
Difúzii, Brownovmu pohybu častíc, ako aj časticovému zloženiu látok vôbec, sa v obsahu fyziky na ZŠ nevenuje toľko priestoru ako v predchádzajúcej koncepcii. Preto práve pokusy s aromatickou látkou a difúziou plynov rozširujú vedomosti žiakov.
Žiacka verzia – Dôkazy časticovej stavby látok
Myšlienka o existencii atómov je veľmi stará. O atómoch už hovorili starovekí Gréci okolo r. 400 pred n. l. Atómová teória, súbor tvrdení, že látky sa skladajú z malých častíc, nazývaných atómy, je dnes už všeobecne prijatá. Pri riešení aktivít sa nebudeme pýtať či atómy jestvujú, budeme však pátrať po ich existencii a usilovať sa lepšie porozumieť časticovému zloženiu látky. Zároveň budeme napodobňovať prácu vedcov pri dokazovaní vybraných výrokov z atómovej teórie.
Teória je súbor tvrdení o predmete výskumu, ktoré v danej etape poznania považujeme za pravdivé. Vyžaduje sa, aby nebola v rozpore so súčasnými skúsenosťami a výsledkami experimentov. Teória je zovšeobecnením skúseností z praxe. Teória často predpovedá vlastnosti a javy, ktoré v čase formulovania teórie ešte neboli prakticky pozorované. Ak sa takéto predpovede potvrdia, je to silný dôkaz o pravdivosti teórie, ak sa nepotvrdia, tak je daná teória neplatná a musí sa preformulovať, alebo musí vzniknúť úplne nová teória.
Pre to, aby bola teória považovaná za vedeckú, musí spĺňať viacero kritérií. Napr. medzi kritéria vedeckej teórie patrí, že skúmaný jav má byť:
- vysvetľovaný čo najjednoduchším spôsobom,
- založený na kontrolovateľných a opakovateľných experimentoch alebo pozorovaniach.
Zostavili sme súbor vybraných výrokov do tzv. „atómovej teórie“, ktoré sa dajú overiť aj v školskom laboratóriu. Časticová stavba látok je predmetom skúmania chémie a fyziky. Vysvetľovanie niektorých javov napr. premeny skupenstva, elektrické javy či chemické vlastnosti látok spočívajú v časticovej stavbe látok.
Budeš sa zamýšľať nad úlohami zadávanými na jednotlivých stanovištiach. Na stanovištiach sú potrebné pomôcky. Podľa návodu vykonaj činnosti, zaznamenaj pozorovania a vysvetlenia. Závery, ktoré si poznačíš do tabuľky 6.2, sa budú týkať aj výrokov, ktoré sú vybrané pre školské skúmanie a majú byť výsledkom diskusie v skupine.
Vybrané výroky atómovej teórie:
1. Telesá z rozličných látok možno rozdeliť na menšie časti.
2. Každá látka je zložená z malých neviditeľných častíc nazývaných atómy.
3. Atómy toho istého prvku majú rovnaké vlastnosti.
4. Atómy rôznych prvkov majú rôzne vlastnosti.
5. Atómy tvoria zlúčeniny v pomere celých čísel.
6. Častice látky sa ustavične neusporiadane pohybujú.
Tabuľka 6.2 Overovanie vybraných výrokov atómovej teórie
 Názov aktivity 1– Pozorovanie tuhých látok
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre tuhé látky
Pomôcky:
Stanovište č. 1 – Petriho miska, krieda, nôž z plastu, nožnice, tenký medený drôt, hárok papiera (obr. 6.8)
Stanovište č. 2 – vypestované kryštály modrej skalice, soli a cukru, lupa (obr. 6.9)
Stanovište č. 3 – obrázky z elektrónového mikroskopu povrchu tuhej látky (uhlík) (obr. 6.10)
Postup práce:
Stanovište č. 1 Pozorovanie delenia kriedy, drôtu a papiera
1. Rozdeľ kriedu nožom z plastu v Petriho miske na malé kúsky.
2. Strihaj medený drôt na malé časti.
3. Strihaj papier na malé časti.
4. Zaznamenaj si do tabuľky svoje pozorovania, ich vysvetlenia a číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 1. (Pred opustením stanovišťa odprac nastrihané kúsky.)
Názov aktivity 1– Pozorovanie tuhých látok
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre tuhé látky
Pomôcky:
Stanovište č. 1 – Petriho miska, krieda, nôž z plastu, nožnice, tenký medený drôt, hárok papiera (obr. 6.8)
Stanovište č. 2 – vypestované kryštály modrej skalice, soli a cukru, lupa (obr. 6.9)
Stanovište č. 3 – obrázky z elektrónového mikroskopu povrchu tuhej látky (uhlík) (obr. 6.10)
Postup práce:
Stanovište č. 1 Pozorovanie delenia kriedy, drôtu a papiera
1. Rozdeľ kriedu nožom z plastu v Petriho miske na malé kúsky.
2. Strihaj medený drôt na malé časti.
3. Strihaj papier na malé časti.
4. Zaznamenaj si do tabuľky svoje pozorovania, ich vysvetlenia a číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 1. (Pred opustením stanovišťa odprac nastrihané kúsky.)
 Stanovište č. 2 Pozorovanie kryštálov
1. Na stanovišti sú kryštály modrej skalice, cukru a soli. Pozoruj kryštály aj pomocou lupy.
2. Zaznamenaj si do tabuľky svoje pozorovania, ich vysvetlenia a číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 2.
Stanovište č. 2 Pozorovanie kryštálov
1. Na stanovišti sú kryštály modrej skalice, cukru a soli. Pozoruj kryštály aj pomocou lupy.
2. Zaznamenaj si do tabuľky svoje pozorovania, ich vysvetlenia a číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 2.
 Stanovište č. 3 Pozorovanie povrchu uhlíka na obrázkoch z elektrónového mikroskopu
Na vedecké účely sa konštruujú mikroskopy, ktoré pri zobrazovaní využívajú aj iné fyzikálne javy ako viditeľné svetlo. Tak napr. v elektrónových mikroskopoch sa na zobrazovanie predmetov využíva vychyľovanie rýchle sa pohybujúcich častíc – elektrónov. Elektrónový mikroskop umožňuje miliónkrát zväčšiť obraz pozorovaného predmetu. Na obrázku je fotografia elektrónového mikroskopu a ukážky pozorovaní elektrónovým mikroskopom, získané v laboratóriách Fakulty matematiky, fyziky a informatiky UK v Bratislave.
Vďaka elektrónovým mikroskopom fyzika získava dôležité a stále nové informácie o stavbe látok. V učebnici fyziky pre 6. ročník ste mali možnosť vidieť obrázky povrchu uhlíka. Biela bodka na obrázku, kde vidieť šupinky povrchu uhlíka, je po milión násobnom zväčšení zobrazená úplne vpravo.
Stanovište č. 3 Pozorovanie povrchu uhlíka na obrázkoch z elektrónového mikroskopu
Na vedecké účely sa konštruujú mikroskopy, ktoré pri zobrazovaní využívajú aj iné fyzikálne javy ako viditeľné svetlo. Tak napr. v elektrónových mikroskopoch sa na zobrazovanie predmetov využíva vychyľovanie rýchle sa pohybujúcich častíc – elektrónov. Elektrónový mikroskop umožňuje miliónkrát zväčšiť obraz pozorovaného predmetu. Na obrázku je fotografia elektrónového mikroskopu a ukážky pozorovaní elektrónovým mikroskopom, získané v laboratóriách Fakulty matematiky, fyziky a informatiky UK v Bratislave.
Vďaka elektrónovým mikroskopom fyzika získava dôležité a stále nové informácie o stavbe látok. V učebnici fyziky pre 6. ročník ste mali možnosť vidieť obrázky povrchu uhlíka. Biela bodka na obrázku, kde vidieť šupinky povrchu uhlíka, je po milión násobnom zväčšení zobrazená úplne vpravo.
 1. Zamysli sa nad obrázkami z elektrónového mikroskopu a zaznamenaj do tabuľky v časti pozorovanie svoj názor, čo zachytil elektrónový mikroskop na povrchu uhlíka.
2. Vo vysvetlení hľadaj argumenty pre svoje tvrdenia. Zapíš si číslo výroku z atómovej teórie do tabuľky.
Zhrňujúce otázky:
1. Ktoré z overovaných výrokov sa pri pozorovaní tuhých látok potvrdili na všetkých troch stanovištiach?
2. Ktoré výroky atómovej teórie skúma chémia?
3. Čo určuje tvar kryštálov?
4. Ktorý technický vynález prispel k potvrdeniu atómovej teórie? Vysvetli svoje tvrdenie.
5. Prezentuj svoje závery z pozorovaní pred triedou. Ktorá skupina vysvetlila svoje pozorovania najlepšie?
Učiteľská verzia k aktivite 1
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre tuhé látky.
Vysvetlenie obsahu aktivity:
Pri realizácii aktivity môže vyučujúci rozšíriť obsah vyučovania, a to v časti vznik kryštálov a získania informácií o elektrónovom mikroskope. Vznik kryštálov by si mali žiaci jednak naštudovať, ale tiež nechať vykryštalizovať nasýtené roztoky cukru či soli ako domácu úlohu.
Kryštály z modrej skalice je potrebné urobiť v školskom laboratóriu nasledovným postupom:
- rozpustiť modrú skalicu v čo najmenšom množstve horúcej vody, urobiť nasýtený roztok,
- vyliať roztok do Petriho misky a dať odparovať na stabilné, nie veľmi teplé miesto,
- po čase sterilným spôsobom vybrať z misky najkrajší kryštál a preložiť do čistej misky, opäť zaliať nasýteným roztokom modrej skalice a nechať na pokojnom mieste kryštalizovať,
- z konečných kryštálov obrúsiť nepravidelnosti.
Kryštalizácia môže byť podnetná pre nasledovné otázky, ktoré zadáme žiakom:
1. Aké podmienky určujú veľkosť kryštálu modrej skalice?
2. Vieme pri kryštalizácii nájsť dôkazy, že sa látky skladajú z častíc?
Pri stanovišti s elektrónovým mikroskopom by mala vyniknúť myšlienka – technické vynálezy posúvajú dopredu vedecké skúmania.
Vyučujúci pripraví 3 stanovištia s pomôckami uvedenými v žiackej verzii. 2 stanovištia sú zložené z reálnych pomôcok, súčasťou tretieho sú obrázky z elektrónového mikroskopu, prípadne počítač s obrázkami. Žiaci by mali pracovať v skupinách, prípadne vo dvojiciach, a preto by mohli byť niektoré stanovištia 2x. Zároveň každý žiak by mal mať vytlačenú tabuľku Overovanie vybraných výrokov atómovej teórie. Na stanovištia odporúčame dať opis aktivity so žiackej verzii a zoznamom výrokov atómovej teórie, ktoré majú žiaci overovať.
Žiaci by mali postupne prechádzať stanovišťami a vykonať na nich potrebné činnosti. Poradie navštívených stanovíšť nie je rozhodujúce.
Záver hodiny je potrebné venovať prezentácii výsledkov skupín a diskusii, ktorá vedie k zovšeobecneniu o časticovej stavbe tuhých látok.
Zhrňujúce otázky:
1. Otázka smeruje k záverečnému zovšeobecneniu. Pre všetky stanovištia platí výrok 2.
2. Ide predovšetkým o výrok 5.
3. Potvrdenie výrokov 3, 4.
4. Diskusia by mala byť zameraná predovšetkým na elektrónový mikroskop.
Názov aktivity 2 – Pozorovanie kvapalín
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre kvapaliny.
Pomôcky:
Stanovište č. 4 – Petriho miska, nôž z plastu, nádoba s vodou, kvapkadlo, utierka (obr. 6.11)
Stanovište č. 5 – batéria (9 V), 3 injekčné striekačky s objemom 20 ml, malé akvárium, 2 tlačky, tenký drôt, plastová hadička 8 cm, stojan so svorkami, kryštalická sóda (Lapitková, 2012, s. 87) (obr. 6.12)
Stanovište č. 6 – atrament, kvapkadlo, voda, kadička 50 ml (obr. 6.13)
Postup práce:
Stanovište č. 4 Pozorovanie delenia vody
1. Nakvapkaj niekoľko kvapiek vody na suchú Petriho misku.
2. Snaž sa plastovým nožom rozdeliť väčšiu kvapku na menšie.
3. Spoj menšie kvapky do jednej väčšej.
4. Zaznamenaj si do tabuľky svoje pozorovania, ich vysvetlenia a číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 4. (Daj stanovište pred opustením do pôvodného stavu.)
1. Zamysli sa nad obrázkami z elektrónového mikroskopu a zaznamenaj do tabuľky v časti pozorovanie svoj názor, čo zachytil elektrónový mikroskop na povrchu uhlíka.
2. Vo vysvetlení hľadaj argumenty pre svoje tvrdenia. Zapíš si číslo výroku z atómovej teórie do tabuľky.
Zhrňujúce otázky:
1. Ktoré z overovaných výrokov sa pri pozorovaní tuhých látok potvrdili na všetkých troch stanovištiach?
2. Ktoré výroky atómovej teórie skúma chémia?
3. Čo určuje tvar kryštálov?
4. Ktorý technický vynález prispel k potvrdeniu atómovej teórie? Vysvetli svoje tvrdenie.
5. Prezentuj svoje závery z pozorovaní pred triedou. Ktorá skupina vysvetlila svoje pozorovania najlepšie?
Učiteľská verzia k aktivite 1
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre tuhé látky.
Vysvetlenie obsahu aktivity:
Pri realizácii aktivity môže vyučujúci rozšíriť obsah vyučovania, a to v časti vznik kryštálov a získania informácií o elektrónovom mikroskope. Vznik kryštálov by si mali žiaci jednak naštudovať, ale tiež nechať vykryštalizovať nasýtené roztoky cukru či soli ako domácu úlohu.
Kryštály z modrej skalice je potrebné urobiť v školskom laboratóriu nasledovným postupom:
- rozpustiť modrú skalicu v čo najmenšom množstve horúcej vody, urobiť nasýtený roztok,
- vyliať roztok do Petriho misky a dať odparovať na stabilné, nie veľmi teplé miesto,
- po čase sterilným spôsobom vybrať z misky najkrajší kryštál a preložiť do čistej misky, opäť zaliať nasýteným roztokom modrej skalice a nechať na pokojnom mieste kryštalizovať,
- z konečných kryštálov obrúsiť nepravidelnosti.
Kryštalizácia môže byť podnetná pre nasledovné otázky, ktoré zadáme žiakom:
1. Aké podmienky určujú veľkosť kryštálu modrej skalice?
2. Vieme pri kryštalizácii nájsť dôkazy, že sa látky skladajú z častíc?
Pri stanovišti s elektrónovým mikroskopom by mala vyniknúť myšlienka – technické vynálezy posúvajú dopredu vedecké skúmania.
Vyučujúci pripraví 3 stanovištia s pomôckami uvedenými v žiackej verzii. 2 stanovištia sú zložené z reálnych pomôcok, súčasťou tretieho sú obrázky z elektrónového mikroskopu, prípadne počítač s obrázkami. Žiaci by mali pracovať v skupinách, prípadne vo dvojiciach, a preto by mohli byť niektoré stanovištia 2x. Zároveň každý žiak by mal mať vytlačenú tabuľku Overovanie vybraných výrokov atómovej teórie. Na stanovištia odporúčame dať opis aktivity so žiackej verzii a zoznamom výrokov atómovej teórie, ktoré majú žiaci overovať.
Žiaci by mali postupne prechádzať stanovišťami a vykonať na nich potrebné činnosti. Poradie navštívených stanovíšť nie je rozhodujúce.
Záver hodiny je potrebné venovať prezentácii výsledkov skupín a diskusii, ktorá vedie k zovšeobecneniu o časticovej stavbe tuhých látok.
Zhrňujúce otázky:
1. Otázka smeruje k záverečnému zovšeobecneniu. Pre všetky stanovištia platí výrok 2.
2. Ide predovšetkým o výrok 5.
3. Potvrdenie výrokov 3, 4.
4. Diskusia by mala byť zameraná predovšetkým na elektrónový mikroskop.
Názov aktivity 2 – Pozorovanie kvapalín
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre kvapaliny.
Pomôcky:
Stanovište č. 4 – Petriho miska, nôž z plastu, nádoba s vodou, kvapkadlo, utierka (obr. 6.11)
Stanovište č. 5 – batéria (9 V), 3 injekčné striekačky s objemom 20 ml, malé akvárium, 2 tlačky, tenký drôt, plastová hadička 8 cm, stojan so svorkami, kryštalická sóda (Lapitková, 2012, s. 87) (obr. 6.12)
Stanovište č. 6 – atrament, kvapkadlo, voda, kadička 50 ml (obr. 6.13)
Postup práce:
Stanovište č. 4 Pozorovanie delenia vody
1. Nakvapkaj niekoľko kvapiek vody na suchú Petriho misku.
2. Snaž sa plastovým nožom rozdeliť väčšiu kvapku na menšie.
3. Spoj menšie kvapky do jednej väčšej.
4. Zaznamenaj si do tabuľky svoje pozorovania, ich vysvetlenia a číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 4. (Daj stanovište pred opustením do pôvodného stavu.)
 Stanovište č. 5 Pozorovanie elektrolýzy vody
1. Na stanovišti prebieha elektrolýza vody. Pozoruj čo sa deje na póloch batérie.
2. Aký plyn sa vyvíja na kladnom a na zápornom póle batérie? Urob predpoklad.
3. Zaznamenaj si do tabuľky svoje pozorovania, predpoklad a vysvetlenie diania na póloch batérie. Zapíš si číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 5.
Stanovište č. 5 Pozorovanie elektrolýzy vody
1. Na stanovišti prebieha elektrolýza vody. Pozoruj čo sa deje na póloch batérie.
2. Aký plyn sa vyvíja na kladnom a na zápornom póle batérie? Urob predpoklad.
3. Zaznamenaj si do tabuľky svoje pozorovania, predpoklad a vysvetlenie diania na póloch batérie. Zapíš si číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 5.
 Stanovište č. 6 Pozorovanie kvapiek atramentu vo vode
1. Kvapni pipetou kvapku atramentu do kadičky s vodou.
2. Chvíľu pozoruj správanie kvapky.
3. Zapíš si pozorovanie a vysvetlenie správania kvapky. Zapíš si do tabuľky číslo výroku z atómovej teórie, ktorý pokus dokazuje. (Daj stanovište pred opustením do pôvodného stavu.)
Stanovište č. 6 Pozorovanie kvapiek atramentu vo vode
1. Kvapni pipetou kvapku atramentu do kadičky s vodou.
2. Chvíľu pozoruj správanie kvapky.
3. Zapíš si pozorovanie a vysvetlenie správania kvapky. Zapíš si do tabuľky číslo výroku z atómovej teórie, ktorý pokus dokazuje. (Daj stanovište pred opustením do pôvodného stavu.)
 Zhrňujúce otázky:
1. Ktoré z overovaných výrokov sa pri pozorovaní kvapalín potvrdili na všetkých troch stanovištiach?
2. Aké vlastnosti látky, atómov (molekúl), možno zaznamenať pri pozorovaní delenia vody? Rovnako sa správali aj tuhé látky?
3. Aké vlastnosti látok, atómov, možno zaznamenať pozorovaním elektrolýzy vody? Ktoré látky vznikajú pri elektrolýze vody? Odkiaľ sa zobrali?
4. Aké vlastnosti častíc dokazuje správanie sa atramentu vo vode po dlhšej dobe?
5. Prezentuj svoje závery z pozorovaní pred triedou. Ktorá skupina vysvetlila svoje pozorovania najlepšie?
Učiteľská verzia k aktivite 2
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre kvapaliny.
Vysvetlenie obsahu aktivity:
Pozorovanie delenia kvapky je založené na analýze vonkajších prejavov kvapaliny. Žiaci na suchú Petriho misku nakvapkali niekoľko kvapiek vody. Delili a spájali kvapky vody nožom z plastu. Dôležité je zistenie, že kvapalinu ľahko rozdelili na niekoľko častí a následne dokázali spojiť do jednej veľkej kvapky.
Molekuly kvapalín držia pohromade určitými silami, ktoré sa dajú ľahko prekonať. Tým môžeme kvapaliny rozdeliť na menšie časti. Príkladom sú aj rôzne spreje naplnené kvapalinami, ktoré stlačením pumpičky ľahko rozprášime na drobné kvapôčky.
Vysvetlenie je v medzimolekulových silách, presnejšie (čo žiaci nemusia vedieť) medzimolekulových väzbových silách: van der Waalsové sily a vodíková väzba. Van der Waalsové sily sú veľmi slabé, a ich podstatou je elektrostatické medzimolekulové pôsobenie. Podstatou vodíkovej väzby, ktorá je omnoho silnejšia, sú príťažlivé sily medzi kladným a záporným čiastkovým nábojom polárnych molekúl. Molekuly musia obsahovať atóm vodíka viazaný na atóm s veľkou hodnotou elektronegativity.
Cieľom aktivity na stanovišti 4 je uskutočniť elektrolýzu vody a potvrdiť vyvíjanie vodíka na katóde a kyslíka na anóde. Elektrolýza je rozklad vody (H2O) na molekuly kyslíka a vodíka v dôsledku pôsobenia elektrického prúdu preneseného cez vodu. Malá časť molekúl vody je rozštiepená na ióny, a preto sa do vody pridáva obyčajne malé množstvo kryštalickej sódy na pranie (Na2CO3), ale aj napr. kyselina sírová. Pri reakcií s vodou sa uvoľňujú molekuly kyslíka O2. Vložili sme do kvapaliny 9 V batériu a dva valce striekačiek naplnené vodou sme položili nad katódu aj anódu. Počas reakcie sa nám uvoľňoval na kladnej elektróde kyslík a na zápornej elektróde vodík a tieto plyny vytláčali zo striekačiek vodu. Už na prvý pohľad si žiaci mohli všimnúť, že jedného plynu je viac ako druhého. Keďže sa rozkladala voda, molekúl vodíka sme zachytili v striekačke viac ako molekúl kyslíka. Pomer vodíka a kyslíka je 2 : 1, čo možno odčítať na stupnici striekačiek. Pri tomto pokuse sa dokázal výrok 5 – Atómy tvoria zlúčeniny v pomere celých čísel.
Pri príprave aparatúry je potrebné valce striekačiek naplniť vodou, ktorú pri elektrolýze vytláčajú plyny. Na obrázku 6.14 je znázornený spôsob ako valce vodou naplniť.
Zhrňujúce otázky:
1. Ktoré z overovaných výrokov sa pri pozorovaní kvapalín potvrdili na všetkých troch stanovištiach?
2. Aké vlastnosti látky, atómov (molekúl), možno zaznamenať pri pozorovaní delenia vody? Rovnako sa správali aj tuhé látky?
3. Aké vlastnosti látok, atómov, možno zaznamenať pozorovaním elektrolýzy vody? Ktoré látky vznikajú pri elektrolýze vody? Odkiaľ sa zobrali?
4. Aké vlastnosti častíc dokazuje správanie sa atramentu vo vode po dlhšej dobe?
5. Prezentuj svoje závery z pozorovaní pred triedou. Ktorá skupina vysvetlila svoje pozorovania najlepšie?
Učiteľská verzia k aktivite 2
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre kvapaliny.
Vysvetlenie obsahu aktivity:
Pozorovanie delenia kvapky je založené na analýze vonkajších prejavov kvapaliny. Žiaci na suchú Petriho misku nakvapkali niekoľko kvapiek vody. Delili a spájali kvapky vody nožom z plastu. Dôležité je zistenie, že kvapalinu ľahko rozdelili na niekoľko častí a následne dokázali spojiť do jednej veľkej kvapky.
Molekuly kvapalín držia pohromade určitými silami, ktoré sa dajú ľahko prekonať. Tým môžeme kvapaliny rozdeliť na menšie časti. Príkladom sú aj rôzne spreje naplnené kvapalinami, ktoré stlačením pumpičky ľahko rozprášime na drobné kvapôčky.
Vysvetlenie je v medzimolekulových silách, presnejšie (čo žiaci nemusia vedieť) medzimolekulových väzbových silách: van der Waalsové sily a vodíková väzba. Van der Waalsové sily sú veľmi slabé, a ich podstatou je elektrostatické medzimolekulové pôsobenie. Podstatou vodíkovej väzby, ktorá je omnoho silnejšia, sú príťažlivé sily medzi kladným a záporným čiastkovým nábojom polárnych molekúl. Molekuly musia obsahovať atóm vodíka viazaný na atóm s veľkou hodnotou elektronegativity.
Cieľom aktivity na stanovišti 4 je uskutočniť elektrolýzu vody a potvrdiť vyvíjanie vodíka na katóde a kyslíka na anóde. Elektrolýza je rozklad vody (H2O) na molekuly kyslíka a vodíka v dôsledku pôsobenia elektrického prúdu preneseného cez vodu. Malá časť molekúl vody je rozštiepená na ióny, a preto sa do vody pridáva obyčajne malé množstvo kryštalickej sódy na pranie (Na2CO3), ale aj napr. kyselina sírová. Pri reakcií s vodou sa uvoľňujú molekuly kyslíka O2. Vložili sme do kvapaliny 9 V batériu a dva valce striekačiek naplnené vodou sme položili nad katódu aj anódu. Počas reakcie sa nám uvoľňoval na kladnej elektróde kyslík a na zápornej elektróde vodík a tieto plyny vytláčali zo striekačiek vodu. Už na prvý pohľad si žiaci mohli všimnúť, že jedného plynu je viac ako druhého. Keďže sa rozkladala voda, molekúl vodíka sme zachytili v striekačke viac ako molekúl kyslíka. Pomer vodíka a kyslíka je 2 : 1, čo možno odčítať na stupnici striekačiek. Pri tomto pokuse sa dokázal výrok 5 – Atómy tvoria zlúčeniny v pomere celých čísel.
Pri príprave aparatúry je potrebné valce striekačiek naplniť vodou, ktorú pri elektrolýze vytláčajú plyny. Na obrázku 6.14 je znázornený spôsob ako valce vodou naplniť.
 Na stanovišti č. 6 je úlohou žiakov analyzovať správanie sa farebnej kvapaliny (najlepšie atramentu) vo vode. Žiaci kvapnú kvapkadlom (pipetou) kvapku atramentu do kadičky s vodou. Kvapalinu nechajú na pokojnom mieste a chvíľu pozorujú jej správanie. Po pozorovaní si zaznamenajú svoje postrehy do tabuľky. Daná aktivita potvrdzuje výrok č. 6 – Častice látky sa ustavične neusporiadane pohybujú.
Všetky tekutiny majú tendenciu prechádzať z prostredia s vyššou koncentráciou do prostredia s nižšou koncentráciou. Prirodzenou vlastnosťou tekutín je, že sa rozptyľujú do celého priestoru, a postupne vo všetkých jeho častiach vyrovnajú svoju koncentráciu. Hovoríme, že látky difundujú.
Pre urýchlenie pozorovania môžeme dať na stanovište 2 kadičky. V jednej budú žiaci pozorovať kvapnutie atramentu a druhá bude stabilne položená na stanovišti ako vzor difúzie častíc atramentu do celého priestoru po dlhšom čase.
Zhrňujúce otázky:
1. Otázka smeruje k záverečnému zovšeobecneniu. Pre všetky stanovištia platí výrok 1.
2. Zdôrazniť by sa mali rozdiely medzi tuhými látkami a kvapalinami, väzby medzi časticami. Dôsledkom iného druhu väzieb pri kvapalinách je opätovné spájanie kvapiek do jedného celku.
3. Potvrdenie výrokov 4, 5. Na rozklad chemickej väzby je potrebná energia (elektrická). Voda sa rozložila na kyslík a vodík.
4. Potvrdenie výroku 6.
Názov aktivity 3 – Pozorovanie plynov
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre plyny
Pomôcky:
Stanovište č. 7 – kadička, striekačka, hadička z plastu, voda (obr. 6.15)
Stanovište č. 8 – aromatická kvapalina uzavretá v nádobe (voňavka, zriedený čpavok, ocot a pod.) (obr. 6.16)
Stanovište č. 9 – 4 striekačky, 2 hadičky, 2 tlačky, stojan, oxid uhličitý (kúsky medeného plechu, kyselina dusičná), digestor, striekačka s bočným vývodom, zátka do skúmavky, hadička na vývod striekačky (obr. 6.17)
Postup práce:
Stanovište č. 7 Pozorovanie delenia vzduchu
1. Nasaj do striekačky s hadičkou vzduch.
2. Vlož hadičku do kadičky s vodou.
3. Pomaly a prerušovanie zatláčaj piest striekačky.
4. Zaznamenaj si do tabuľky svoje pozorovanie, vysvetlenie a číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 71. (Daj stanovište pred opustením do pôvodného stavu.)
Na stanovišti č. 6 je úlohou žiakov analyzovať správanie sa farebnej kvapaliny (najlepšie atramentu) vo vode. Žiaci kvapnú kvapkadlom (pipetou) kvapku atramentu do kadičky s vodou. Kvapalinu nechajú na pokojnom mieste a chvíľu pozorujú jej správanie. Po pozorovaní si zaznamenajú svoje postrehy do tabuľky. Daná aktivita potvrdzuje výrok č. 6 – Častice látky sa ustavične neusporiadane pohybujú.
Všetky tekutiny majú tendenciu prechádzať z prostredia s vyššou koncentráciou do prostredia s nižšou koncentráciou. Prirodzenou vlastnosťou tekutín je, že sa rozptyľujú do celého priestoru, a postupne vo všetkých jeho častiach vyrovnajú svoju koncentráciu. Hovoríme, že látky difundujú.
Pre urýchlenie pozorovania môžeme dať na stanovište 2 kadičky. V jednej budú žiaci pozorovať kvapnutie atramentu a druhá bude stabilne položená na stanovišti ako vzor difúzie častíc atramentu do celého priestoru po dlhšom čase.
Zhrňujúce otázky:
1. Otázka smeruje k záverečnému zovšeobecneniu. Pre všetky stanovištia platí výrok 1.
2. Zdôrazniť by sa mali rozdiely medzi tuhými látkami a kvapalinami, väzby medzi časticami. Dôsledkom iného druhu väzieb pri kvapalinách je opätovné spájanie kvapiek do jedného celku.
3. Potvrdenie výrokov 4, 5. Na rozklad chemickej väzby je potrebná energia (elektrická). Voda sa rozložila na kyslík a vodík.
4. Potvrdenie výroku 6.
Názov aktivity 3 – Pozorovanie plynov
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre plyny
Pomôcky:
Stanovište č. 7 – kadička, striekačka, hadička z plastu, voda (obr. 6.15)
Stanovište č. 8 – aromatická kvapalina uzavretá v nádobe (voňavka, zriedený čpavok, ocot a pod.) (obr. 6.16)
Stanovište č. 9 – 4 striekačky, 2 hadičky, 2 tlačky, stojan, oxid uhličitý (kúsky medeného plechu, kyselina dusičná), digestor, striekačka s bočným vývodom, zátka do skúmavky, hadička na vývod striekačky (obr. 6.17)
Postup práce:
Stanovište č. 7 Pozorovanie delenia vzduchu
1. Nasaj do striekačky s hadičkou vzduch.
2. Vlož hadičku do kadičky s vodou.
3. Pomaly a prerušovanie zatláčaj piest striekačky.
4. Zaznamenaj si do tabuľky svoje pozorovanie, vysvetlenie a číslo výroku z atómovej teórie, ktoré podporuje pozorovanie na stanovišti č. 71. (Daj stanovište pred opustením do pôvodného stavu.)
 Stanovište č. 8 Pozorovanie aromatickej látky
1. Na stanovišti je uzavretá nádoba s aromatickou látkou. Otvor nádobu a daj ju približne 30 cm od nosa.
2. Zaznamenaj si do tabuľky svoje pozorovanie, vysvetlenie a čísla výrokov z atómovej teórie, ktoré podporujú pozorovanie na stanovišti č. 8.
Stanovište č. 8 Pozorovanie aromatickej látky
1. Na stanovišti je uzavretá nádoba s aromatickou látkou. Otvor nádobu a daj ju približne 30 cm od nosa.
2. Zaznamenaj si do tabuľky svoje pozorovanie, vysvetlenie a čísla výrokov z atómovej teórie, ktoré podporujú pozorovanie na stanovišti č. 8.
 Stanovište č. 9 Pozorovanie plynov v striekačkách
Na obrázku sú dvojice injekčných striekačiek. Striekačky sú naplnené plynmi už dlhší čas. Na začiatku pokusu bol tlačkou oddelený oxid dusičitý (hustejší plyn) od vzduchu (redšieho plynu). V druhej dvojici boli rovnaké plyny, ale umiestnene plynov je presne naopak ako v prvej dvojici. Deje v striekačkách prebiehali aspoň 24 hodín.
Stanovište č. 9 Pozorovanie plynov v striekačkách
Na obrázku sú dvojice injekčných striekačiek. Striekačky sú naplnené plynmi už dlhší čas. Na začiatku pokusu bol tlačkou oddelený oxid dusičitý (hustejší plyn) od vzduchu (redšieho plynu). V druhej dvojici boli rovnaké plyny, ale umiestnene plynov je presne naopak ako v prvej dvojici. Deje v striekačkách prebiehali aspoň 24 hodín.
 1. Dá sa po dlhšom čase rozlíšiť, v ktorej skúmavke bol priezračný vzduch a v ktorej hnedý oxid dusičitý?
2. Zaznamenaj si do tabuľky svoje pozorovanie, vysvetlenie a čísla výrokov z atómovej teórie, ktoré podporujú pozorovanie na stanovišti č. 9.
Zhrňujúce otázky:
1. Ktoré z overovaných výrokov sa potvrdili pri pozorovaní plynov na 8. a 9. stanovišti?
2. Čo sa udialo s bublinkami plynov vytlačených zo striekačky do vody?
3. Ako si vysvetľuješ skutočnosť, že kvapalnú aromatickú látku možno cítiť aj do vzdialenosti 30 cm od hladiny kvapaliny, prípadne aj do väčšej vzdialenosti?
4. Čo sa udialo s plynmi rôznej hustoty po dlhšej dobe? Ako je možné, že hustejší plyn nezostal len v spodnej striekačke?
5. Prezentuj svoje závery z pozorovaní pred triedou. Ktorá skupina vysvetlila svoje pozorovania najlepšie?
Zhrňujúce otázky k aktivitám 1-3:
1. Ktoré z overovaných výrokov sa potvrdili pri pozorovaní tuhých, kvapalných a plynných látkach? Ktorý výrok (výroky) mal(i) najväčšiu podporu na jednotlivých stanovištiach?
2. Ktoré z výrokov možno dokázať len špeciálnymi zariadeniami, prístrojmi?
3. Ktoré ďalšie experimenty by si vedel navrhnúť ako dôkaz výrokov atómovej teórie?
4. Ako by si charakterizoval a porovnal väzby medzi časticami v tuhých, kvapalných a plynných látkach?
5. Platí výrok č. 6 aj pre tuhé látky? Vysvetli svoju predstavu o pohybe častíc v tuhých, kvapalných a plynných látkach.
Učiteľská verzia k aktivite 3
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre plyny.
Vysvetlenie obsahu aktivity:
Aktivita s aromatickou látkou nepriamo dokazuje neustály pohyb častíc. Na stanovišti možno použiť aromatické látky napr. voňavku alebo ocot.
Na stanovišti žiaci otvoria nádobu s kvapalnou aromatickou látkou a dajú si ju približne 30 cm od tváre. Chvíľu nádobu podržia v uvedenej vzdialenosti a zaznamenajú si do tabuľky svoje pozorovania, vysvetlenia a výroky.
Daná aktivita je prejavom difúzie plynov. Všetky látky majú tendenciu prechádzať z prostredia s jej vyššou koncentráciou do prostredia s jej nižšou koncentráciou. Prirodzenou vlastnosťou látok je, že sa jej častice rozptyľujú do celého priestoru. Ide aj o dôsledok neustáleho, neusporiadaného pohybu častíc. Hovoríme, že látky difundujú.
Zostavenie pokusu a aparatúry na stanovišti č. 9 – Pozorovanie plynov v striekačkách, by mal vyučujúci pripraviť bez prítomnosti žiakov a v digestóriu. Ide o vyrobenie plynu oxidu dusičitého, ktorý je výhodný pre svoju výrazne hnedú farbu. Potrebujeme na výrobu malé kúsky medeného plechu, ktorý v skúmavke zalejeme kyselinou dusičnou. Pri reakcii vzniká hnedý plyn. Najlepšie je použiť skúmavku s bočným otvorom. Skúmavku pri vzniku plynu zazátkujeme a necháme otvorený bočný otvor pre únik vzduchu. Po naplnení celej skúmavky plynom môžeme z bočného otvoru nasať plyn do dvoch striekačiek na ktorých je hadička s tlačkou. Prípadne možno použiť aj iný, menej škodlivý plyn, podmienkou je, aby bol farebný.
Striekačky upevníme na stojan tak, ako je to uvedené na obr. 6.17 v žiackej verzii. V jednej sústave striekačiek bol tlačkou oddelený oxid dusičitý od vzduchu. V druhej dvojici boli rovnaké plyny ale umiestnené presne naopak. Deje v striekačkách môžu prebiehať do ďalšej hodiny, kde sú súčasťou stanovišťa č. 9.
Difúzia prebieha vo všetkých skupenstvách. Najrýchlejšie prebieha v plynoch, pretože v plynoch sa molekuly najrýchlejšie pohybujú. Pomocou neustáleho pohybu častíc sa plyny časom usporiadali tak, že hustejší a redší plyn sa premiešajú.
Zhrňujúce otázky:
1. Predovšetkým výrok 2.
2. Bublinky stúpali k hladne vody. Vysvetlenie môžeme akceptovať cez hustotu, alebo hydrostatickú vztlakovú silu (pokiaľ sa so žiakmi preberala v 8. ročníku hydrostatická vztlaková sila).
3. Vyparovaním molekúl a neustálym, neusporiadaným pohybom častíc (výrok č. 6).
4. Platí výrok č. 6. V diskusii by sa mohla položiť otázka gravitačného pôsobenia na častice plynu a neusporiadaný pohyb častíc a ich vzájomné nárazy.
Zhrňujúce otázky k aktivitám 1-3:
1. Ide predovšetkým i výroky č. 1 a 2.
2. Výrok 3 (kryštály) a výrok 5 (elektrolýza vody).
3. Tu je potrebné nechať žiakov voľne navrhovať pokusy z fyziky či chémie.
4. Charakteristika látok sa môže opierať o F7 s. 63.
5. Odpoveď sa môže opierať o obsah v učebnici fyziky pre 7. ročník (Lapitková, 2010b, s. 63).
Tabuľka 6.3 Výsledok pozorovania žiakov
1. Dá sa po dlhšom čase rozlíšiť, v ktorej skúmavke bol priezračný vzduch a v ktorej hnedý oxid dusičitý?
2. Zaznamenaj si do tabuľky svoje pozorovanie, vysvetlenie a čísla výrokov z atómovej teórie, ktoré podporujú pozorovanie na stanovišti č. 9.
Zhrňujúce otázky:
1. Ktoré z overovaných výrokov sa potvrdili pri pozorovaní plynov na 8. a 9. stanovišti?
2. Čo sa udialo s bublinkami plynov vytlačených zo striekačky do vody?
3. Ako si vysvetľuješ skutočnosť, že kvapalnú aromatickú látku možno cítiť aj do vzdialenosti 30 cm od hladiny kvapaliny, prípadne aj do väčšej vzdialenosti?
4. Čo sa udialo s plynmi rôznej hustoty po dlhšej dobe? Ako je možné, že hustejší plyn nezostal len v spodnej striekačke?
5. Prezentuj svoje závery z pozorovaní pred triedou. Ktorá skupina vysvetlila svoje pozorovania najlepšie?
Zhrňujúce otázky k aktivitám 1-3:
1. Ktoré z overovaných výrokov sa potvrdili pri pozorovaní tuhých, kvapalných a plynných látkach? Ktorý výrok (výroky) mal(i) najväčšiu podporu na jednotlivých stanovištiach?
2. Ktoré z výrokov možno dokázať len špeciálnymi zariadeniami, prístrojmi?
3. Ktoré ďalšie experimenty by si vedel navrhnúť ako dôkaz výrokov atómovej teórie?
4. Ako by si charakterizoval a porovnal väzby medzi časticami v tuhých, kvapalných a plynných látkach?
5. Platí výrok č. 6 aj pre tuhé látky? Vysvetli svoju predstavu o pohybe častíc v tuhých, kvapalných a plynných látkach.
Učiteľská verzia k aktivite 3
Úloha:
Hľadaj dôkazy podporujúce výroky atómovej teórie pre plyny.
Vysvetlenie obsahu aktivity:
Aktivita s aromatickou látkou nepriamo dokazuje neustály pohyb častíc. Na stanovišti možno použiť aromatické látky napr. voňavku alebo ocot.
Na stanovišti žiaci otvoria nádobu s kvapalnou aromatickou látkou a dajú si ju približne 30 cm od tváre. Chvíľu nádobu podržia v uvedenej vzdialenosti a zaznamenajú si do tabuľky svoje pozorovania, vysvetlenia a výroky.
Daná aktivita je prejavom difúzie plynov. Všetky látky majú tendenciu prechádzať z prostredia s jej vyššou koncentráciou do prostredia s jej nižšou koncentráciou. Prirodzenou vlastnosťou látok je, že sa jej častice rozptyľujú do celého priestoru. Ide aj o dôsledok neustáleho, neusporiadaného pohybu častíc. Hovoríme, že látky difundujú.
Zostavenie pokusu a aparatúry na stanovišti č. 9 – Pozorovanie plynov v striekačkách, by mal vyučujúci pripraviť bez prítomnosti žiakov a v digestóriu. Ide o vyrobenie plynu oxidu dusičitého, ktorý je výhodný pre svoju výrazne hnedú farbu. Potrebujeme na výrobu malé kúsky medeného plechu, ktorý v skúmavke zalejeme kyselinou dusičnou. Pri reakcii vzniká hnedý plyn. Najlepšie je použiť skúmavku s bočným otvorom. Skúmavku pri vzniku plynu zazátkujeme a necháme otvorený bočný otvor pre únik vzduchu. Po naplnení celej skúmavky plynom môžeme z bočného otvoru nasať plyn do dvoch striekačiek na ktorých je hadička s tlačkou. Prípadne možno použiť aj iný, menej škodlivý plyn, podmienkou je, aby bol farebný.
Striekačky upevníme na stojan tak, ako je to uvedené na obr. 6.17 v žiackej verzii. V jednej sústave striekačiek bol tlačkou oddelený oxid dusičitý od vzduchu. V druhej dvojici boli rovnaké plyny ale umiestnené presne naopak. Deje v striekačkách môžu prebiehať do ďalšej hodiny, kde sú súčasťou stanovišťa č. 9.
Difúzia prebieha vo všetkých skupenstvách. Najrýchlejšie prebieha v plynoch, pretože v plynoch sa molekuly najrýchlejšie pohybujú. Pomocou neustáleho pohybu častíc sa plyny časom usporiadali tak, že hustejší a redší plyn sa premiešajú.
Zhrňujúce otázky:
1. Predovšetkým výrok 2.
2. Bublinky stúpali k hladne vody. Vysvetlenie môžeme akceptovať cez hustotu, alebo hydrostatickú vztlakovú silu (pokiaľ sa so žiakmi preberala v 8. ročníku hydrostatická vztlaková sila).
3. Vyparovaním molekúl a neustálym, neusporiadaným pohybom častíc (výrok č. 6).
4. Platí výrok č. 6. V diskusii by sa mohla položiť otázka gravitačného pôsobenia na častice plynu a neusporiadaný pohyb častíc a ich vzájomné nárazy.
Zhrňujúce otázky k aktivitám 1-3:
1. Ide predovšetkým i výroky č. 1 a 2.
2. Výrok 3 (kryštály) a výrok 5 (elektrolýza vody).
3. Tu je potrebné nechať žiakov voľne navrhovať pokusy z fyziky či chémie.
4. Charakteristika látok sa môže opierať o F7 s. 63.
5. Odpoveď sa môže opierať o obsah v učebnici fyziky pre 7. ročník (Lapitková, 2010b, s. 63).
Tabuľka 6.3 Výsledok pozorovania žiakov
